背景
肝細胞がん(肝がん)の治療としては、手術療法、肝動脈塞栓療法(TAE)、ラジオ波焼灼療法(RFA)をはじめとする局所療法、抗がん剤を用いた化学療法が施行される。肝がん診療における問題点として、早期発見して根治的局所治療が施されても極めて高い再発率を示し、単発肝がん切除後3年での再発率が72%に達している。 本研究の様にTAE実施後にRFAを実施した試験において、無再発生存率が1、3、5年後においてそれぞれ、64.5 %、40.1 %、18.0 %と報告されている。この報告では、TAEではなく抗がん剤を混ぜたTACEとして実施している。TAE実施後のRFAを実施した例においても、長期的には多くが再発していることから、再発肝がんに対する治療が繰り返されることとなり、繰り返された症例ほど生命予後が悪化するという傾向にある。
動脈塞栓術と樹状細胞(抗原未感作樹状細胞)局注療法との融合
動脈塞栓術(TAE)は、動脈の中にカテーテルを通し、なるべく病変の近くまでカテーテルを進めて血管塞栓物質を注入し、目的の病変を治療する方法で、狭義でいわゆる“腫瘍の兵糧攻め”と言われる治療法である。さらに広い意味では塞栓物質を注入して血流を調整し、治療部位での薬剤分布をよくすることで薬剤の治療効果を増強させる方法である。
本試験では、この方法を更に発展させて「抗がん剤」や「樹状細胞」を治療箇所で徐放させるDDS(Drug & Dendritic cell Delivery System)を応用する新技術の臨床研究を推進する。
樹状細胞免疫療法臨床試験
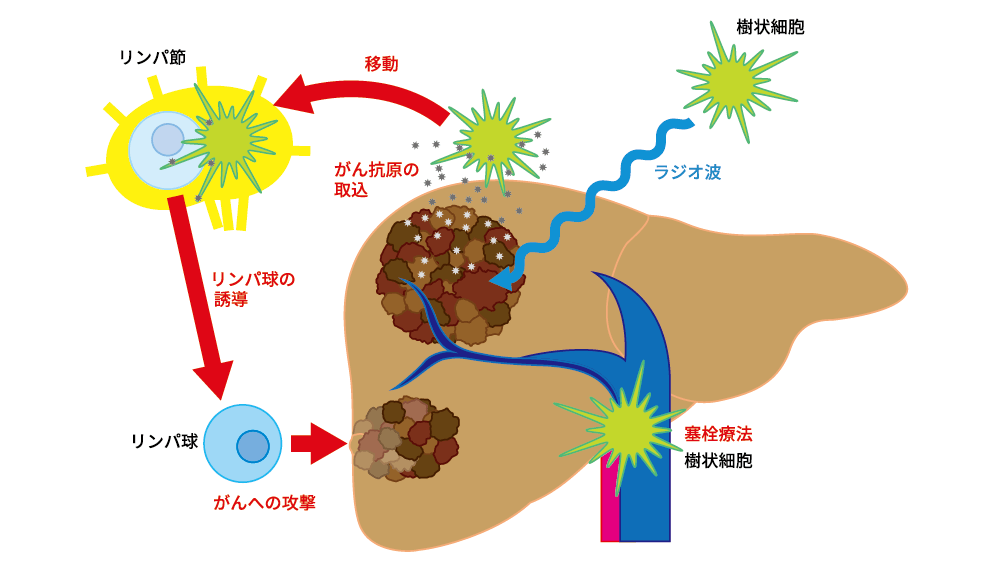
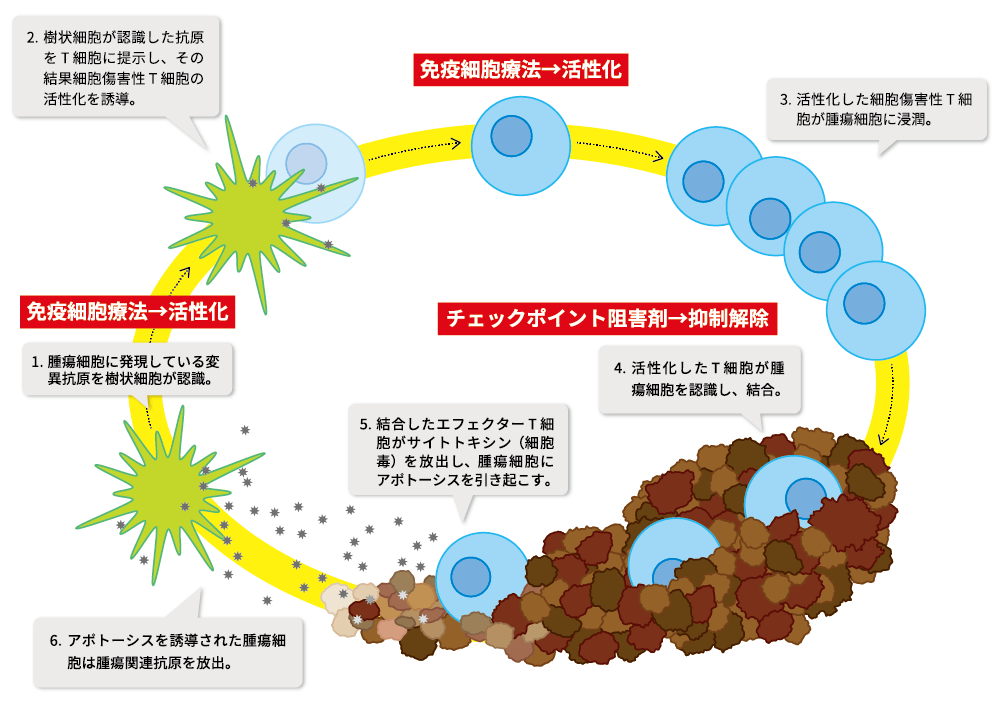
がん免疫サイクルを効率よく動かす
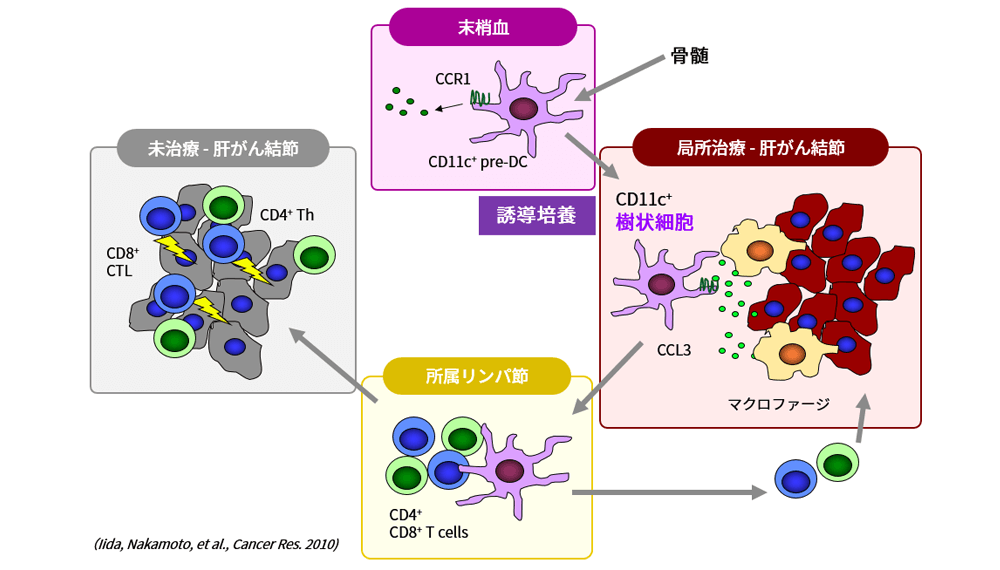
本試験の狙いを、がんサイクルに基づいてこれを説明する。局所治療(RFA)によってがん細胞が細胞死(アポトーシス)に陥り、抗原提示細胞つまり樹状細胞(dendritic cells)が活性化されて成熟すると、リンパ節に移動してTリンパ球の賦活化を誘導することとなる。賦活化されたTリンパ球は血管内から腫瘍組織に浸潤して、がん細胞を攻撃するものと考えられる。そこで、アポトーシスに陥った腫瘍組織に樹状細胞を追加することは、さらに強力な全身の抗腫瘍免疫を誘導することに繋がると考えられる。その結果として、肝がんの再発を単一細胞(シングルセル)レベルで阻止することができると考えている。
これまでの成果
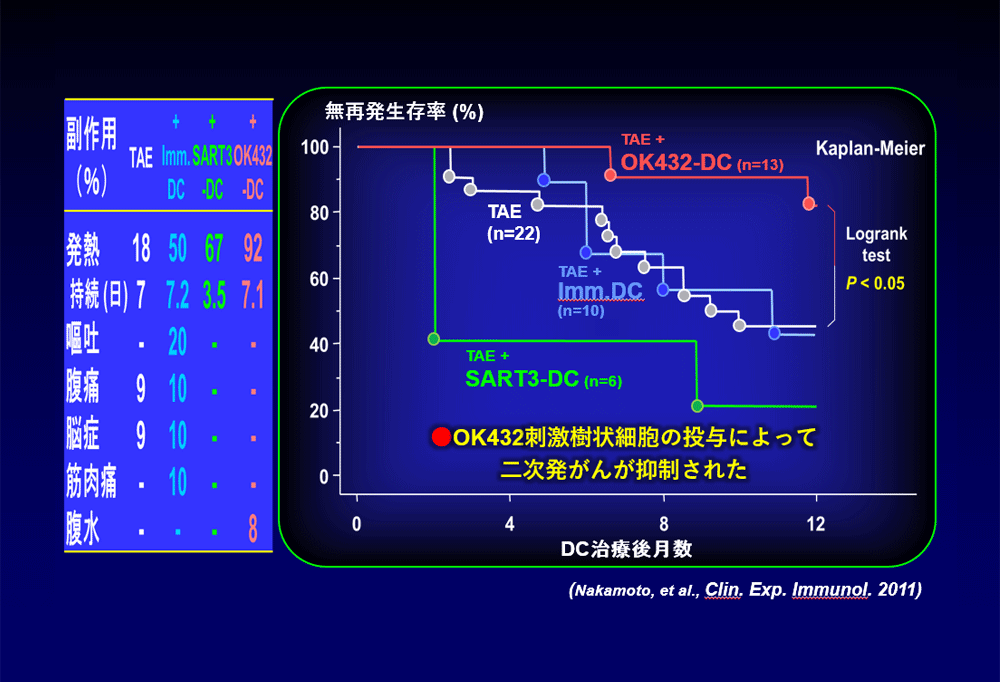
一連の臨床研究のまとめを示す。図表左の副作用において、樹状細胞を投与しないヒストリカルコントロール(TAE:白)に比べて、各種の樹状細胞治療によって発熱の頻度は増加したものの発熱の持続期間に延長はなく、NCI-CTCグレード3以上の有害事象はみられなかった。図表右の無再発生存率については、ヒストリカルコントロールに比べてOK432刺激した樹状細胞(OK432-DC:赤)によって著明な再発の抑制効果が観察された。これより、OK432刺激樹状細胞の投与によってがん免疫が賦活化され、再発(二次発がん)が抑制されたことが示唆された。またこれらの臨床研究の成果は、TAEによるがん細胞のアポトーシスが引き金となるCancer-Immunity Cycleにおいて、樹状細胞の投与がさらに反応を加速する方向で作用すること、そして最終的に腫瘍細胞の増殖が抑制されたものと推察された。
動脈塞栓術と併用する樹状細胞治療 安全性と治療効果
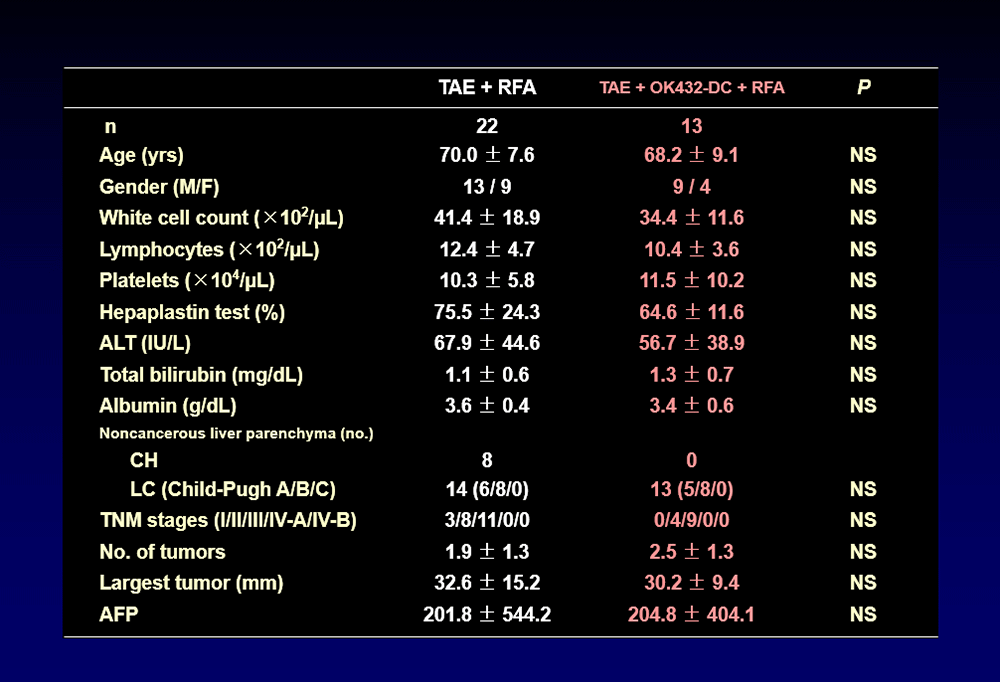
次に、ヒストリカルコントロール(TAE+RFA)とOK432治療例(TAE+O432-DC+RFA)の臨床背景を比較した。両群の臨床的因子、慢性肝疾患の進展度、腫瘍病期、腫瘍数、最大腫瘍径、AFP値に差異は認められなかった。
動脈塞栓術と併用する樹状細胞療法 臨床背景
樹状細胞治療によって 再発(二次発がん)が抑制される作用機序
樹状細胞治療によって再発(二次発がん)が抑制された作用機序について検討した。図表の上段では、CD8陽性Tリンパ球についてがんペプチドへの反応性をELISPOT法で検討した。OK432刺激樹状細胞を用いた治療によって一部の抗原に対する反応が誘導された。DTH皮内反応からは、CD4陽性Tリンパ球が誘導されていることが示唆された。下段では、多数のサイトカイン、ケモカインについてBioPlex法を用いて観察した。
動脈塞栓術と併用する樹状細胞療法 作用機序
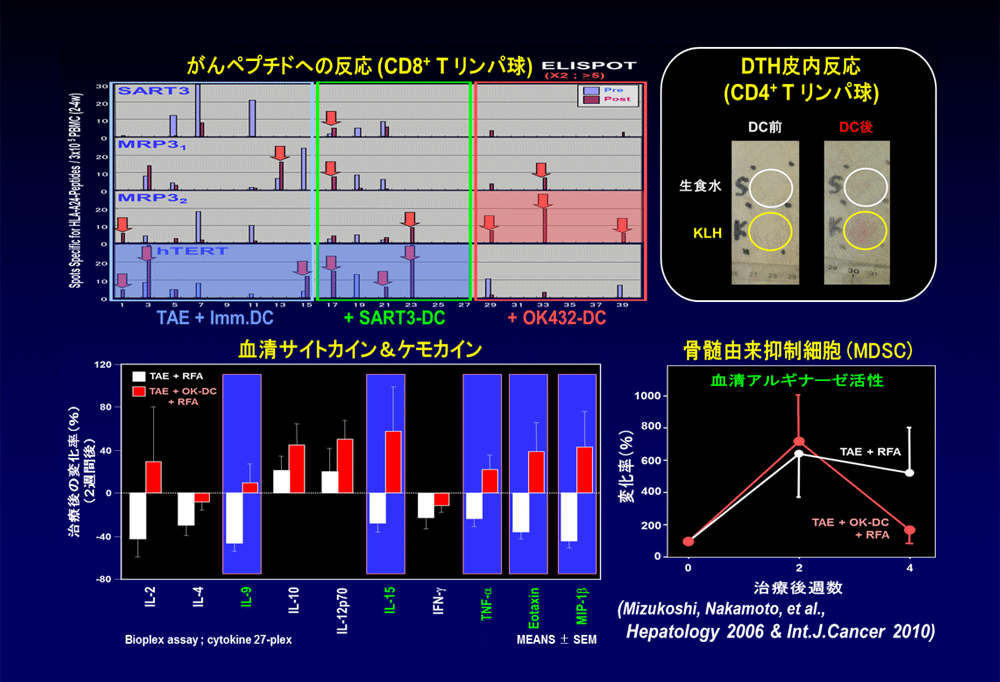
IL-9、IL-15、TNF-α、Eotaxin、MIP-1βというTh1タイプのサイトカインが樹状細胞の有無によって反応性に違いを認めた。つまり、樹状細胞を投与していないヒストリカルコントロール(白)では低下しているのに対して、OK432-樹状細胞の投与(赤)によって増加する方向に変化していることが分かった。これに対して、IL-4、IL-10などのTh2サイトカインは変化しなかった。また、治療後には抗腫瘍免疫に抑制的に作用する骨髄由来抑制細胞(MDSC)の活性が低下傾向を示した。これらの結果から、OK432-樹状細胞によってTh1タイプの免疫反応が誘導されるとともに、免疫抑制系の作用が軽減されることによって抗腫瘍効果が発揮された可能性が示された。
以上の研究成果から、末梢血から誘導培養された樹状細胞を肝がんの局所治療部位に投与する手法は、Tリンパ球を介して全身の抗腫瘍免疫を増強する効果を発揮し、新たながんの発生(再発:二次発がん)を抑制する治療手段となる可能性が示唆された。
肝がん局所治療と樹状細胞による免疫賦活作用
詳細を閉じる