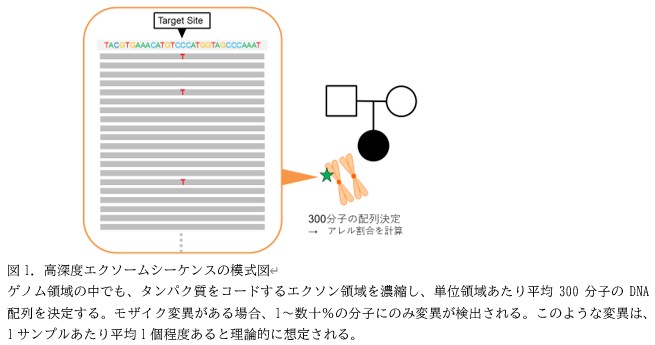
モザイク変異は、一部の細胞のみに存在する変異であり、すべての細胞に共通する生殖系列変異に比べると、検出が難しく、特にシーケンス解析のエラーとの鑑別が容易ではありません。そこで、研究グループは、194名の双極性障害の参加者については、参加者本人の両親も参加をお願いし、そのシーケンスデータを用いることで、伝達される生殖系列変異などの偽陽性所見を除去することで、精度高くモザイク変異を検出する手法を用いました。発端者とその両親のトリオのデータを用いることで、90%以上の精度を実現し、低割合モザイク変異の検出としては国際的にも高い精度で解析を行うことが可能となりました。
まず194の双極性障害患者トリオ家系(患者とその両親)のシーケンスデータに対し品質管理を行い、高品質と確認された190トリオから、合計162個の高精度なモザイク変異を検出しました。これらのモザイク変異の特徴を調べると、重篤な発達障害原因遺伝子上の機能障害モザイク変異*8が双極性障害患者さんに多いことがわかり当初の仮説を支持するデータが得られました。この特徴は、対照データには認められず、双極性障害のモザイク変異に特徴的といえる結果でした。重篤な発達障害だけでなく、自閉症の原因遺伝子にも同様の特徴が確認されました。
さらに、重篤な発達障害原因遺伝子上の機能障害モザイク変異の中でも、ARID2という遺伝子上の機能喪失変異が検出されました。この変異は、疾患原因変異データベースにおいてCoffin-Siris症候群*9という神経発達障害で生殖系列変異として登録されているものと同じ変異であることから、病原性が十分想定できます。すなわち、この変異については、生殖系列変異として生じるとCoffin-Siris症候群をもたらし、モザイク変異として生じると双極性障害をもたらす、という可能性が考えられます。そのほかにも同様のモザイク変異が複数見つかり、このような重篤な発達障害・自閉症の原因遺伝子における機能障害性の変異を集めると、遺伝子にコードされるタンパク質が密接に結合してネットワークを形成することがわかりました。すなわち、双極性障害において、このような遺伝子の変異が病態の一部を構成している可能性があるといえます。190トリオ以外の、41名の双極性障害患者試料についてもモザイク変異を探索したところ、3名から発達障害原因遺伝子における機能障害性の変異が検出され、一方対照者39名には検出されず、仮説に支持的な結果となりました。
次に研究グループは、ミトコンドリアゲノムにおけるモザイク状の変異も同様に調べました。ミトコンドリアは細胞核とは独立して細胞内に多数ありますが、すべてのミトコンドリアに共通するホモプラスミー変異と、一部のミトコンドリアにしかないヘテロプラスミー変異があり、ヘテロプラスミー変異がモザイク状に存在する変異にあたります。今回の研究では、190トリオから33個のヘテロプラスミー変異を検出しました。ミトコンドリアDNAは、13個のタンパク質をコードする遺伝子と、22個のトランスファーRNA (tRNA)をコードする遺伝子、2個のリボソームRNA (rRNA) をコードする遺伝子をもっており*10、研究グループは、ミトコンドリアDNA上の変異を、タンパク質をコードする遺伝子のうちアミノ酸配列を変えない変異(同義変異)、タンパク質をコードする遺伝子のうちアミノ酸配列を変える変異(非同義変異)、tRNA 変異、rRNA変異の4種類に分類し、それぞれについて、生殖系列として継承されるホモプラスミー変異と比較しました。結果、同義変異・非同義変異・rRNA変異の割合は差がなかったものの、tRNA変異については、ヘテロプラスミー変異において割合が多いということがわかりました。
tRNA変異は、他の変異に比べると病原性をもちやすく、そもそもホモプラスミーであるよりヘテロプラスミーとして存在しやすいという特徴があります。そこで、tRNAのヘテロプラスミー変異について、双極性障害と他の一般集団データを比較して、双極性障害における特徴を調べました。まず日本人ゲノムの大規模データである東北大学東北メディカルメガバンク (ToMMo*11)のデータと比較したところ、双極性障害トリオではtRNAの変異が多い一方で、ToMMoトリオではそのような傾向はみられませんでした。英国からの一般集団を用いた報告と比較しても、双極性障害トリオではtRNAの変異が多い一方で、比較対照ではそのような傾向はみられず、双極性障害においてtRNA変異が多いということが示唆されました。特に機能障害性と予測されるtRNA変異ではより双極性障害における頻度が高いという結果でした。ここから、トリオに限らず235名の双極性障害参加者と39名の対照者の参加者全体で比較したところ、前者では15名でtRNAにおけるヘテロプラスミー変異が検出された一方で、後者では0名でした。この結果も、本結果を支持するデータといえます。
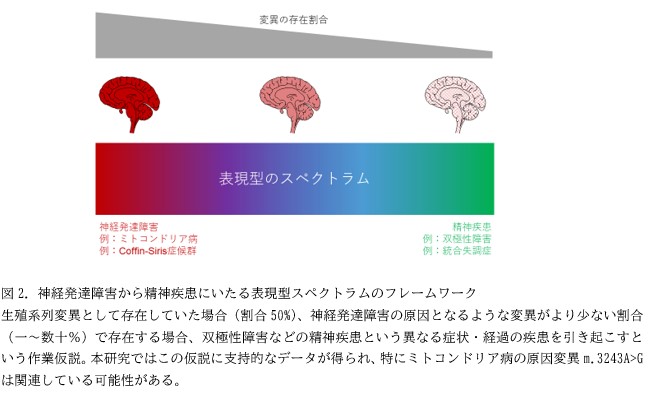
tRNA変異の中でも、m.3243A>G変異という変異が、独立した2名の双極性障害参加者から検出されました。双極性障害235名のうち、同じモザイク状の変異が検出されたのは、このm.3243A>G変異だけでした。m.3243A>G変異は、重篤な神経発達障害のひとつといえるミトコンドリア病MELAS*12の原因変異として知られていますが、本研究で検出されたヘテロプラスミー変異は、全DNAの5~15%で検出され、MELASではその割合が20%以上と差があります。すなわち、変異の存在割合によって症状・経過に差が生じることが予想されます。このm.3243A>G変異が、一般集団よりも双極性障害で多いかどうかを大規模一般集団データ、(日本人ゲノムデータであるToMMo、その他の国際ゲノムデータ)と比較したところ、双極性障害では、一般集団よりもm.3243A>G変異の頻度が高いと考えられました。ミトコンドリア病をもつ患者では双極性障害の症状をもつ患者の割合が一般集団よりも高く、特にm.3243A>G変異をもつミトコンドリア病MELASの患者においてその割合が多いことが知られていますが、ミトコンドリア病の症状をもたない双極性障害においても、m.3243A>G変異が関連している、ひいては原因となっている可能性が考えられます。
本研究では、高深度エクソームシーケンスを用い、「重篤な神経発達障害の原因遺伝子におけるモザイク変異が双極性障害に多い」という仮説に支持的なデータを得ることができました。すなわち、生殖系列変異として生じると重篤な神経発達障害をもたらすような変異が、体細胞モザイク変異として生じた場合、双極性障害をもたらすのではないかということが考えられます。ミトコンドリアtRNA変異についても同様に、高い割合で存在する場合には重篤なミトコンドリア病をもたらし、相対的に低い割合で存在する場合には、双極性障害をもたらすという可能性が考えられます。従来別々な疾患とされていたものの背景に共通する因子があるとすれば、疾患横断的な病態理解・治療方法の開発が可能となると考えられます。
■今後の展開
今回、研究グループは双極性障害の遺伝学的構造として、体細胞モザイク変異が関連している可能性があることを示し、特に神経発達障害遺伝子上のモザイク変異やミトコンドリアtRNAヘテロプラスミー変異が注目すべき対象であることを見出しました。本研究は、双極性障害の病態理解に貢献するものですが、しかし限界もあります。本研究では唾液や血液など末梢試料を使用しており、血液のみにみられるモザイク変異も一定割合で混じっていると考えられます。最終的には脳試料を用いて、今回の知見を検証していく必要があります。また、双極性障害モザイク変異研究としては国際的に最大の参加者にて研究を行うことができましたが、対照との比較という意味では十分なサンプルサイズでの検証は行えておらず、確証的な知見を得るには十分な数の参加者にて検証を行う必要があります。
■用語解説
*1 双極性障害:気分の落ち込みや興味・喜びの喪失を主症状とする抑うつ状態と、気分の高揚や過活動を主とする躁状態を繰り返す主要な精神疾患の一つ。
*2 ミトコンドリアトランスファーRNA:メッセンジャーRNAからタンパク質への翻訳を行う際に、アミノ酸の運搬を行うRNAをトランスファーRNA (tRNA) と呼び、ミトコンドリアは細胞質に存在するtRNAと異なる独自のtRNAをもつ。
*3 ヘテロプラスミー変異:ミトコンドリアDNA全体のうち、一部のミトコンドリアDNAにのみ存在する変異をヘテロプラスミー変異と呼ぶ。すべてのミトコンドリアに共通する変異をホモプラスミー変異と呼ぶ。
*4 m.3243A>G変異:ミトコンドリアDNAの3243番目のポジションにおけるアデニンがグアニンに置換した変異
*5 重篤な発達障害:発生発達の過程で障害が生じ、知的障害や解剖学的な特徴を伴う表現型をもつ障害群を指す。
*6 Nishioka et al. Systematic analysis of exonic germline and postzygotic de novo mutations in bipolar disorder. Nature Communications 12:3750 (2021)
https://www.nature.com/articles/s41467-021-23453-w
*7双極性障害研究ネットワーク(BDRNJ):双極性障害に関する研究成果の発信、研究参加のご案内を通して、双極性障害の原因を研究している研究者と当事者・家族をつなぐネットワーク (http://bipolar.umin.jp/)
*8 機能障害モザイク変異:変異が存在する遺伝子がコードするタンパク質に関して、その機能を喪失させる、またはアミノ酸変化を通して機能に障害をもたらすと予測されるモザイク変異
*9 Coffin-Siris症候群:重度の知的障害、成長障害、特徴的な顔貌(疎な頭髪、厚い口唇など)、手足の低形成を主徴とする重篤な発達障害のひとつ
*10 tRNA, rRNA:前述(*2)の通りメッセンジャーRNAからタンパク質への翻訳を行う際に、アミノ酸の運搬を行うRNAをトランスファーRNA (tRNA) と呼ぶ。リボソームRNA (rRNA) は、メッセンジャーRNAからタンパク質への翻訳を行う分子機械であるリボソームを構成するRNAのことを指す。
*11 東北大学東北メディカルメガバンク (ToMMo):未来型医療を築いて震災復興に取り組むために東北大学に設置された機関であり、東日本大震災の被災地の地域医療再建と健康支援に取り組みながら、医療情報とゲノム情報を複合させたバイオバンクを構築している。日本人ゲノムデータとして最大のデータベースを保有している。
*12 MELAS:mitochondrial myopathy, encephalopathy, lactic acidosis, and stroke-like episodesの略であり、ミトコンドリア病の中では頻度の高い病気である。脳卒中様症状を主とし、痙攣や知能障害を伴うことが多い。筋症状や低身長など様々な合併臓器症状を伴う。患者の80%にm.3243A>Gを認めると報告されている。
研究者のコメント
現在、末梢試料を用いた研究のサンプルサイズを拡張し、確証的な知見を得ることを目指す方向で更に探究を進めており、また脳試料におけるモザイク変異の解析も開始しています。確証的な知見を得ることで、双極性障害の病態を明らかに、ゲノム特徴をもとにした新たな治療法の開発・既存の治療方法の最適化を進め、双極性障害に対するゲノム精密医療を実現したいと考えています。
本研究は、日本双極性障害研究ネットワーク(BDRNJ, http://bipolar.umin.jp/)から参加いただいた参加者の皆様、ご両親のおかげで実施することができました。この場を借りて感謝申し上げます。双極性障害の病態理解を更に進め、治療方法の最適化・新たな治療方法の開発につなげるべく、双極性障害のゲノム因子の探索を引き続き進めています。双極性障害をお持ちの方、そのご両親、精神疾患のない対照の方の参加を随時募集しており、ご興味にある方は、https://www.juntendo-molecular-psychiatry.com/にアクセスいただき、bipolar@juntendo.ac.jpまでご連絡いただければ幸いです。また双極性障害に関する研究の情報を月一回程度の頻度で配信する双極性障害研究ネットワーク(BDRNJ, http://bipolar.umin.jp/)でも双極性障害に関する情報を発信していますので、こちらもアクセスいただければと思います。
原著論文
本研究はInternational Journal of EFGH誌のオンライン版に2023年5月30日付で公開されました。
タイトル: Deep exome sequencing identifies enrichment of deleterious mosaic variants in neurodevelopmental disorder genes and mitochondrial tRNA regions in bipolar disorder
タイトル(日本語訳):高深度エクソームシーケンスにより、双極性障害における神経発達障害遺伝子・ミトコンドリアtRNAのモザイクバリアントの濃縮が特定される
著者:Masaki Nishioka, Jun Takayama, Naomi Sakai, An-a Kazuno, Mizuho Ishiwata, Junko Ueda, Takashi Hayama, Kumiko Fujii, Toshiyuki Someya, Shinichi Kuriyama, Gen Tamiya, Atsushi Takata, Tadafumi Kato
著者(日本語表記): 西岡将基1,2,3、高山順4、酒井直美1,3、数野安亜3、石渡みずほ1,3、林順子3、早馬俊5、藤井久彌子6、染矢俊幸7、栗山進一4、田宮元4、高田篤3,8、加藤忠史1,2,3
著者所属:1) 順天堂大学・医学部・精神医学講座 2) 順天堂大学・医学部・気分障害分子病態学講座 3) 理化学研究所・脳神経科学研究センター 4) 東北大学・東北メディカル・メガバンク機構 5) 医療法人南山会・横浜メンタルクリニック戸塚 6) 滋賀医科大学・医学部・精神医学講座 7) 新潟大学・医学部・精神医学教室 8) 順天堂大学・医学部・老人性疾患病態・治療研究センター
DOI: 10.1000.333.444.doi,2000
本研究は、AMEDゲノム医療実現推進プラットフォーム・先端ゲノム研究開発22tm0424224、AMED革新的技術による脳機能ネットワークの全容解明22dm0207074、JSPS科研費22H00468、JSPS科研費21K15722、およびジョンズホプキンス大学共同研究計画ニューロロジープロジェクトの支援を受け多施設との共同研究の基に実施されました。本研究にご協力いただいた皆様に深謝いたします。