JUNTENDO News&Events ニュース&イベント
2023.03.21 (TUE)
- 研究活動
- メディアの方へ
- 企業・研究者の方へ
- 医学研究科
致死性遺伝性不整脈の患者由来iPS細胞モデル ―カルモジュリン変異が引き起こす重症不整脈―
順天堂大学医学部薬理学講座 小林 琢也 助教、呉林 なごみ 客員准教授、村山 尚 先任准教授、京都大学大学院医学研究科地域医療システム学・循環器内科学 牧山 武 特定講師、高 景山 博士課程学生、山本 雄大 研究員(現:スタンフォード大学ポスドク)らの研究グループは、カルモジュリン変異が致死性不整脈を引き起こすメカニズムに関して、患者iPS細胞由来の心筋細胞(注1)モデルを用いて明らかにしました。
カルモジュリンは普遍的に存在するカルシウム結合タンパク質であり、さまざまな生命機能に重要な役割を果たしています。近年、カルモジュリン遺伝子の異常により、重症な不整脈疾患が引き起こされることが報告されましたが、その疾患発症機序はまだ十分に解明されていません。本研究では、運動誘発性心室頻拍の症例から樹立したiPS細胞から分化させた心筋細胞の解析、組換えカルモジュリンタンパク質を用いた生化学的解析により、重症不整脈発症のメカニズムを明らかにしました(図1)。本研究はカルモジュリン変異によるカテコラミン誘発性多形性心室頻拍(注2)における初めての疾患iPS細胞モデルの報告となり、疾患発症機序の理解と新規治療法の開発(プレシジョン・メディシン)につながると期待されます。本成果は、2023年3月21日に米国の国際学術誌「Circulation: Arrhythmia and Electrophysiology」にオンライン掲載されました。
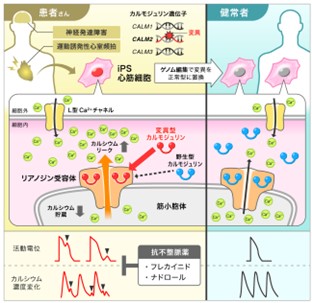
図1 本研究の概要図
カルモジュリン関連カテコラミン誘発性多形性心室頻拍(CPVT)に関して、疾患iPS細胞モデルを用いて不整脈発症メカニズムを解明した。
変異型カルモジュリンが、リアノジン受容体へ優先的に結合し、筋小胞体から細胞質へのカルシウムリークを生じさせ、重症不整脈を引き起こす。(図左)
本研究成果のポイント
- カルモジュリン変異を有する運動誘発性心室頻拍の患者由来iPS細胞モデルにおいて重症不整脈を再現
- 組換えタンパク質を用いた生化学的手法により分子メカニズムを解明
- iPS細胞モデルにおいて抗不整脈薬の薬効を評価
背景
カルモジュリンは、真核細胞に普遍的に発現しており、カルシウムイオンのセンサーとして様々なタンパク質と相互作用することによりその機能を調節しています。カルモジュリン遺伝子は3つあり(CALM1-3)、いずれも全く同じアミノ酸配列をコードしています。近年、これらCALM遺伝子の変異が、重症な遺伝性不整脈疾患(先天性QT延長症候群やカテコラミン誘発性多形性心室頻拍(CPVT)など)を引き起こすことが報告され、カルモジュリン関連不整脈疾患「カルモジュリノパチー」として注目されています。ヒト心筋細胞においてCALM遺伝子変異が致死性不整脈を引き起こすメカニズムに関してはまだ十分に解明されておらず、我々は、疾患iPS細胞モデルを用いた研究を計画しました。
研究手法・成果
運動時に心室頻拍にて失神を来たしたCPVT症例において遺伝子解析を行い、血縁関係のない2症例においてCALM2遺伝子に同じヘテロ接合性ミスセンス変異(E46K)を検出しました。患者末梢血よりiPS細胞を樹立し、コントロールのiPS細胞としては、健常人由来株とゲノム編集により患者由来iPS細胞の変異を修復した株(アイソジェニックコントロール)を用いました。iPS細胞を心筋細胞へ分化させて、電気生理学的解析を行い、患者由来心筋細胞では、筋小胞体から細胞質へのカルシウムりークにより異常な電気的興奮(図2)やカルシウム動態異常が認められ、CPVTの特徴を再現していました。
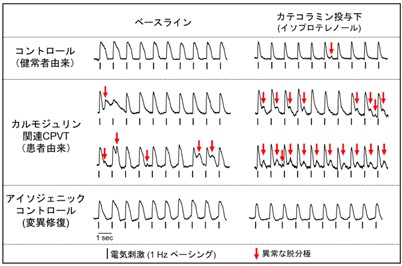
図2 iPS細胞由来心筋細胞における電気生理学的解析
分化心筋細胞の膜電位イメージング波形。患者由来iPS細胞より分化させた心筋細胞(中段)は、コントロール(健常人由来株、遺伝子変異修復株)に比べて、異常な電気的興奮(赤矢印)を示し、カテコラミン誘発性多形性心室頻拍(CPVT)の特徴を再現していた。
カルモジュリンは、通常、筋小胞体から細胞質へカルシウムイオンを放出するリアノジン受容体(RyR2)(注3)の機能を抑制する生理的な働きがありますが、生化学的解析により、変異型カルモジュリンは、野生型カルモジュリンと比べてRyR2に優先的に結合し(図3)、逆に筋小胞体からのカルシウムリークを促進していることが分かり、CALM遺伝子変異が重症不整脈を引き起こす仕組みが明らかとなりました。
さらに、臨床で使用される抗不整脈薬(ナドロール、フレカイニド)が、患者iPS細胞由来心筋細胞において抗不整脈効果を示しました(図4)。
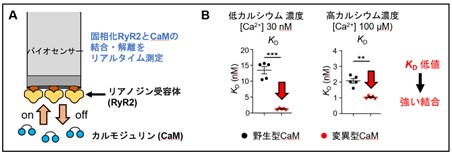
図3 カルモジュリンとリアノジン受容体(RyR2)の結合親和性解析
A.バイオレイヤー干渉法の原理
B.変異型カルモジュリンは、特に低Ca2+濃度下(左)において強い結合親和性を示した。
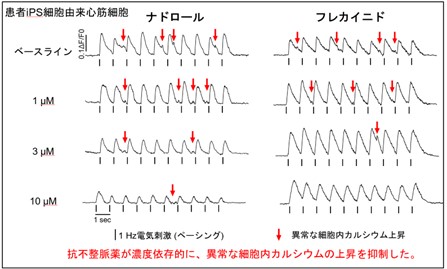
図4 患者iPS細胞由来心筋細胞における薬効評価。
カルシウムイメージングの代表波形。抗不整脈(ナドロール、フレカイニド)が異常な細胞内カルシウム上昇(赤矢印)を濃度依存性に抑制した。
波及効果、今後の予定
本研究は、カルモジュリン関連CPVTに関する初めての疾患iPS細胞モデルの報告であり、疾患発症機序や抗不整脈薬の薬効に関する知見は、実際の患者診療や原因遺伝子に応じた精密医療「プレシジョン・メディシン」の開発に大きく貢献すると考えています。また、本遺伝子変異を持つ2症例は、重症不整脈に加えて神経発達障害も有しており、カルモジュリン変異が中枢神経系にも影響を与えることが示唆されます。今後、新規治療法の開発、神経細胞における解析など患者診療への還元を目指して研究を進めて行きたいと考えています。
研究プロジェクトについて
- 本研究は、下記の支援を受けて実施されました。
日本学術振興会科学研究費補助金(JP16K09499, JP19K08538, JP19K17595, JP19K07105, JP19H03404, JP20K11368, JP22K06652, JP22H02805) - 日本医療研究開発機構(AMED)(JP18ek0109202, JP19ek0109202, JP20bm0804022, JP20bm0104001, JP20am0101080 (2621), JP21bm0804022, JP20lm0203006(A164)
- 鈴木謙三記念医科学応用研究財団
- 車両競技公益資金記念財団 (6114, 6237, 6303)
用語解説
注1)患者iPS細胞由来心筋細胞
ヒトの皮膚や末梢血単核球などの体細胞に、リプログラミング因子を導入することにより、様々な組織の細胞に分化する能力とほぼ無限に増殖する能力を持つ多能性幹細胞(iPS細胞:induced pluripotent stem cell)を作製できます。iPS細胞を特定の条件で培養すると心筋細胞に分化させることができ、心疾患を研究するために使用されています。
注2)カテコラミン誘発性多形性心室頻拍(CPVT)
CPVTは、運動や情動の変化などカテコラミン刺激により心室頻拍が誘発され、心室細動に移行して失神、突然死を起こす致死的不整脈の一つです。主にリアノジン受容体 (RyR2)の遺伝子異常によって引き起こされます。近年、カルモジュリン遺伝子の変異によって重症なCPVTが引き起こされることが報告されています。
注3)2 型リアノジン受容体
2型リアノジン受容体(RyR2)は、筋小胞体から細胞質へカルシウムイオンを放出するチャネルであり、心臓の興奮収縮連関において重要な役割を果たしています。
論文タイトルと著者
タイトル:Novel calmodulin variant p.E46K associated with severe CPVT produces robust arrhythmogenicity in human iPSC-derived cardiomyocytes
重症 CPVT 症例において同定された新規カルモジュリン変異p.E46K は、ヒト iPS細胞由来心筋細胞において重度な催不整脈性を示す
著者:Jingshan Gao, Takeru Makiyama*, Yuta Yamamoto, Takuya Kobayashi, Hisaaki Aoki,Thomas L. Maurissen, Yimin Wuriyanghai, Asami Kashiwa, Tomohiko Imamura,Takanori Aizawa, Hai Huang, Hirohiko Kohjitani, Misato Nishikawa, Kazuhisa Chonabayashi, Megumi Fukuyama, Hiromi Manabe, Kouichi Nakau, Tsutomu Wada, Koichi Kato,Futoshi Toyoda, Yoshinori Yoshida, Naomasa Makita, Knut Woltjen, Seiko Ohno,Nagomi Kurebayashi, Takashi Murayama*, Takashi Sakurai, Minoru Horie, Takeshi Kimura(*責任著者)
掲載誌:Circulation: Arrhythmia and Electrophysiology DOI:10.1161/CIRCEP.122.011387