JUNTENDO News&Events ニュース&イベント
2023.06.12 (MON)
- 順天堂大学について
- 受験生の方へ
- 学校・塾の関係者の方へ
- メディアの方へ
- 医学部
細胞のストレス応答の新しい仕組みを発見 ―細胞内の巨大構造体「p62顆粒」の新たな役割を解明―
順天堂大学大学院医学研究科器官・細胞生理学の小松雅明 教授、一村義信 先任准教授、北海道大学遺伝子病制御研究所生命分子機構分野の野田展生 教授らの研究グループは、p62顆粒*1を介した細胞のストレス応答の新しい仕組みを解明しました。細胞の酸化ストレス応答は、KEAP1-NRF2経路*2により一元的に制御されています。これまで、細胞はKEAP1が酸化修飾されることで酸化ストレスを感知し、転写因子NRF2を活性化し、一連の抗酸化たんぱく質の発現を誘導することが知られていました。今回、リン酸化酵素*3ULK1がp62顆粒をリン酸化することでKEAP1をp62顆粒内に封じ込め、KEAP1の酸化修飾がなくともNRF2を活性化する新しい仕組みを明らかにし、この経路をレドックス*4非依存性ストレス応答と名付けました。マウスの生体内において強制的にレドックス非依存性ストレス応答を活性化させると、マウスは過剰な生体防御反応のため食道や前胃上皮細胞の過角化*5を起こし、その結果、栄養失調や脱水を引き起こすことも分かりました。リン酸化されたp62顆粒は肝疾患、神経変性疾患やがんの病変部において異常蓄積することが知られており、これら疾患の病態発症機序の解明につながることが期待されます。
本論文はThe EMBO Journal誌のオンライン版に2023年6月12日付で公開されました。
本研究成果のポイント
- 細胞内の巨大な構造体p62顆粒の新たな役割とその調節の仕組みを発見。
- p62顆粒を介したストレス応答の異常は食道や胃の閉塞を引き起こす。
■背景
液―液相分離とは、均一に混ざり合った溶液が互いに溶け合わない二相に分離する現象のことであり、細胞内ではたんぱく質や核酸同士の弱い相互作用によって起こることが知られています。液―液相分離によって周囲の細胞質から区画化された構造体は液滴と呼ばれ、近年、様々な液滴が同定され、それらは遺伝子発現、たんぱく質翻訳、ストレス応答、たんぱく質分解など多様な生命現象を制御することが明らかになってきています。p62顆粒は、ユビキチン化たんぱく質と結合することで液−液相分離した液滴であり、選択的オートファジー*6により分解されることが知られていました。一方、p62顆粒が持つ生理機能に関しては不明なままでした。
■内容
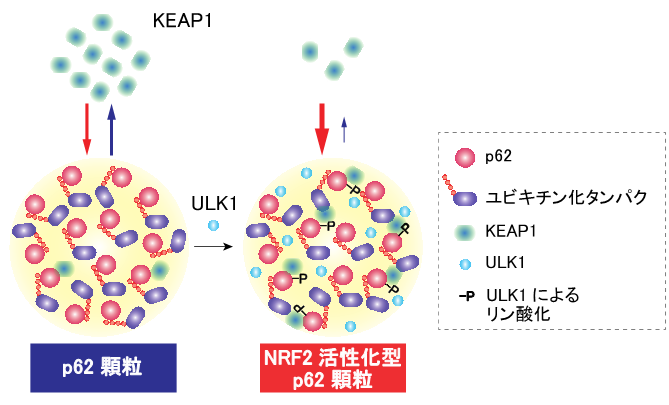
今回、研究グループは、p62顆粒は細胞のストレス応答を制御する液滴であることを見出しました。高速原子間力顕微鏡*7など高度な研究手法により、ULK1がp62と直接相互作用し、p62をリン酸化することが明らかになりました(図1)。さらに、光退色後蛍光回復や光退色後蛍光損失法*8を駆使し、細胞においてULK1はp62顆粒に局在化し、p62顆粒をリン酸化することでKEAP1をp62顆粒内に封じ込めることが分かりました。その結果、p62顆粒はKEAP1の酸化修飾がなくともNRF2を活性化する、というこれまで全く知られていなかったストレス応答経路を見出すことに成功し、この経路を「レドックス非依存性ストレス応答」と名付けました(図2)。
この新たなストレス応答経路の個体における意義を明らかにするため、強制的にレドックス非依存性ストレス応答を活性化するマウスを作製、解析した結果、このマウスは過剰な生体防御反応のために食道や前胃の上皮細胞の過角化を起こし、食道や前胃の閉塞による栄養失調や脱水を引き起こしました。
以上の解析を通じて、細胞内の新たなストレス応答の仕組みとして、KEAP1をリン酸化p62液滴に隔離することで活性化するレドックス非依存性ストレス応答の存在が初めて明らかになりました。



■今後の展開
今回の成果は細胞のストレス応答機構や液―液相分離の生理的役割について新たな知見を与えるものです。また、p62顆粒は肝疾患、神経変性疾患の病変細胞や肝細胞がんにおいて過剰に蓄積することが知られており、これら病態においてレドックス非依存性ストレス応答が調整不全となっていることが強く疑われ、それら重篤な疾患の病態発症機序の解明が期待されます。
■用語解説
*1 p62顆粒: 肝細胞がんや神経変性疾患の病変細胞では巨大な構造体であるp62顆粒を形成する。p62は、たんぱく質恒常性の破綻、酸化ストレス、あるいは炎症性ストレスなどにより発現誘導される多機能たんぱく質である。最も代表的なオートファジー選択的分解基質であり、ユビキチン化たんぱく質と結合することで液−液相分離を起こす。
*2 KEAP1-NRF2経路: NRF2は酸化ストレス応答を制御する主要な転写因子である。通常は、KEAP1が結合することでユビキチン化され、プロテアソームで恒常的に分解されている。一方、細胞が酸化ストレスを感知するとKEAP1が酸化修飾を受けてNRF2から解離する。その結果、NRF2は核内へ移行し、様々な生体防御遺伝子群の発現を誘導する。レドックス異常を伴わない変性したたんぱく質が蓄積した場合もNRF2が活性化されることが知られているが、その制御機構は不明のままであった。
*3 リン酸化酵素: たんぱく質は遺伝子の転写、翻訳により作られ、その後、化学修飾を受けて機能が調節されることもある。リン酸化は最も多くのたんぱく質で行われる翻訳後修飾であり、リン酸化を担う酵素をリン酸化酵素と呼ぶ。
*4 レドックス: 英語のReduction (還元)とOxidation (酸化)を合わせた言葉で酸化還元を意味する。通常、細胞内は様々な抗酸化酵素の作用で還元状態が維持されている。ミトコンドリアの酸素呼吸、あるいは外的要因で酸化状態に陥ると細胞を保護するための酸化ストレス応答が発動される。
*5 過角化: 上皮細胞の異常な分化などにより上皮最表面の扁平上皮が肥圧化した状態を過角化と呼ぶ。食道上皮細胞の過剰な角化は扁平上皮がんで確認される癌真珠と呼ばれる構造体の形成につながる。
*6 選択的オートファジー: 細胞内の特定のたんぱく質や細胞小器官(ミトコンドリアや小胞体など)を選択的にオートファゴソームに取り込み、リソソーム(分解酵素を格納している細胞小器官)で分解する作用。選択的オートファジーの異常はがんや神経変性疾患と関連すると考えられている。
*7 高速原子間力顕微鏡: 原子間力顕微鏡(AFM)は、走査(スキャン)によってカンチレバー探針(プローブ)と試料(サンプル)とを力学的に接触させ、溶液中の生体分子をナノメートル(nm=10Å)の分解能で直接観察できる顕微鏡。高速AFMは、従来型のAFMに比べ、画像取得に必要な時間を数百分の1に短縮・高速化した装置。1枚の画像取得に要する時間は従来型のAFMでは数分以上を要していたが、高速AFMではミリ秒程度の短時間で行える。そのため、生体分子の反応や構造変化をリアルタイムで観察できる。
*8 光退色後蛍光回復と光退色後蛍光損失法: 細胞内の観察対象となる特定領域に存在する蛍光分子に対して、強い励起光を照射し退色させ、その後の蛍光回復を計時的に測定する手法を光退色後蛍光回復と呼ぶ。逆に、観察対象以外の部分を退色させ後、観察対象の蛍光損失の計時変化を測定する手法を光退色後蛍光損失法と呼ぶ。これらの解析を用いることで細胞内の分子の移動速度や流動性を知ることができる。
■原著論文
本研究はThe EMBO Journal 誌のオンライン版に2023 年6 月12 日付で公開されました。
英文タイトル: Phosphorylation of phase-separated p62 bodies by ULK1 activates a redox-independent
stress response
タイトル(日本語訳):相分離したp62 顆粒のULK1 によるリン酸化は、酸化還元非依存的なストレス応答を活性化する
著者:Ryo Ikeda1,2, Daisuke Noshiro3, Hideaki Morishita1, Shuhei Takada1, Shun Kageyama1, Yuko Fujioka3,
Tomoko Funakoshi1, Satoko Komatsu-Hirota1, Ritsuko Arai4, Elena Ryzhii4, Manabu Abe5, Tomoaki Koga6,
Hozumi Motohashi7, Mitsuyoshi Nakao6, Kenji Sakimura5, Arata Horii2, Satoshi Waguri4, Yoshinobu
Ichimura1,*, Nobuo N Noda3,* and Masaaki Komatsu1,*
著者(日本語表記):池田良1,2, 能代大輔3, 森下英晃1, 高田周平1, 蔭山俊1, 藤岡優子3, 船越智子1, 小松(廣田) 聡子1, 荒井律子4, Elena Ryzhii 4, 阿部学5, 古賀友紹6, 本橋ほづみ7, 中尾光善6, 﨑村建司5, 堀井新2, 和栗聡4, 一村義信1,*, 野田展生3,* 小松雅明1,*
*共同責任著者
著者所属:1)順天堂大学大学院医学研究科器官・細胞生理学分野、2) 新潟大学大学院医歯学総合研究科耳鼻咽喉科・頭頸部外科学分野、3)北海道大学遺伝子病制御研究所生命分子機構分野、4)福島県立医科大学医学部解剖・組織学講座、5) 新潟大学脳研究所モデル動物開発分野、6) 熊本大学発生医学研究所発生制御部門細胞医学分野、7)東北大学加齢医学研究所加齢制御研究部門遺伝子発現制御分野
DOI: 10.15252/embj.2022113349
本研究はJSPS科研費(20K06549, 21K06178, 21H04163, 20H03213, 20K06644, 19H05707, 19H05706, 21H004771)、革新的先端研究開発支援事業AMED-PRIME (21gm6410019h0001)、戦略的創造研究推進事業JST-CREST(JPMJCR20E3)、生命科学・創薬研究支援基盤事業AMED-BINDS (JP19am0101001_support no. 0002)、革新的先端研究開発支援事業AMED-CREST (22gm1410004h0003)、日本学術振興会A3フォーサイト事業、稲盛財団、武田科学振興財団などの支援を受け実施されました。なお、本研究にご協力いただいた皆様には深謝いたします。