JUNTENDO News&Events ニュース&イベント
2023.07.19 (WED)
- 順天堂大学について
- 受験生の方へ
- 学校・塾の関係者の方へ
- メディアの方へ
- 医学部
ピロリ菌が胃がん発症を促進する新たな仕組みを解明 カエル胚の発生異常を手がかりにピロリ菌のがんタンパク質の新たな細胞内標的分子を発見
微生物化学研究会・微生物化学研究所(第3生物活性研究部)の畠山昌則部長(兼 北海道大学・遺伝子病制御研究所・感染癌研究センター 特任教授)、順天堂大学大学院医学研究科(生化学・生体システム医科学)の金光(髙橋)昌史助教らの国際共同研究グループは、ピロリ菌のがんタンパク質CagAが胃がんの発症を促進する新たなメカニズムを明らかにしました。研究グループは、CagAをカエルの胚に発現すると胚の正常な発生が阻害される現象を見出し、これを手がかりとして、CagAが胃上皮培養細胞でVANGLというタンパク質と結合し、その機能を阻害することを発見しました。さらに、全身の細胞の中から胃の上皮細胞にのみCagAを発現することができる遺伝子改変マウスを作製し、このマウスを用いたピロリ菌感染の模倣実験によって、実際の胃の粘膜上皮でCagAがVANGLの機能を阻害して、胃上皮の幹細胞/前駆細胞の異常増殖を引き起こすことを明らかにしました。本成果は、VANGLの機能異常が、ピロリ菌感染による胃発がんにとどまらず、広範な上皮組織における発がんのメカニズムに重要な役割を担うことを示唆する新規知見です。
本論文は、米国科学振興協会が発行するScience誌の姉妹誌、「Science Signaling」誌のオンライン版に2023年7月18日付で公開されました。
本研究成果のポイント(主な発見)
- アフリカツメガエルの胚にCagAを発現すると、上皮細胞の協調的な集団移動が阻害され、形態異常の胚が発生する
- CagAによる細胞集団移動の阻害は、CagAがVANGLというタンパク質と結合し、VANGLの機能を抑制することが原因で生じる
- マウスの胃の粘膜上皮で、CagAは実際にVANGLの機能を阻害し、細胞増殖を異常に活性化する
◆背景
ヘリコバクター・ピロリ(ピロリ菌)*1は、ヒトの胃粘膜に慢性感染する細菌で、感染した胃上皮細胞にCagAタンパク質*2を注入することで胃がんの発症を促します。今日までのヒト胃上皮培養細胞を用いた研究から、CagAは胃上皮細胞内で細胞内シグナル*3を伝達する種々のタンパク質とC端側領域を用いて結合し、発がんに関わる細胞内シグナルを撹乱することが明らかにされてきました。一方で、「生体内すなわちピロリ菌が主に棲息する胃の幽門・前庭部*4の粘膜上皮で、CagAはどのように発がんを促進するのか?」、「CagAの機能不詳のN端側領域には、どのような病原活性が存在するのか?」など、未解明の課題が多く残されていました。研究グループはCagAが撹乱する未知の細胞内シグナルを明らかにすることで、この問題を克服しようと考えました。その手がかりとして、アフリカツメガエル*5の胚*6にCagAタンパク質を発現させ、その発生過程を正常な胚と比較する実験を発案しました。アフリカツメガエルの胚がオタマジャクシへと正常に発生する仕組みは分子レベルでよく理解されており、適切に制御された細胞内シグナルによる細胞増殖・細胞分化・細胞移動の統合的な調節がその本態として知られます。研究グループは、CagAを発現させたアフリカツメガエルの胚が発生の過程で異常をきたした場合、その発生異常の背景にあるシグナル異常を詳細に解析することで、ヒト胃上皮でCagAが撹乱する新たな細胞内シグナルを見つけ出せると考えました。
◆内容
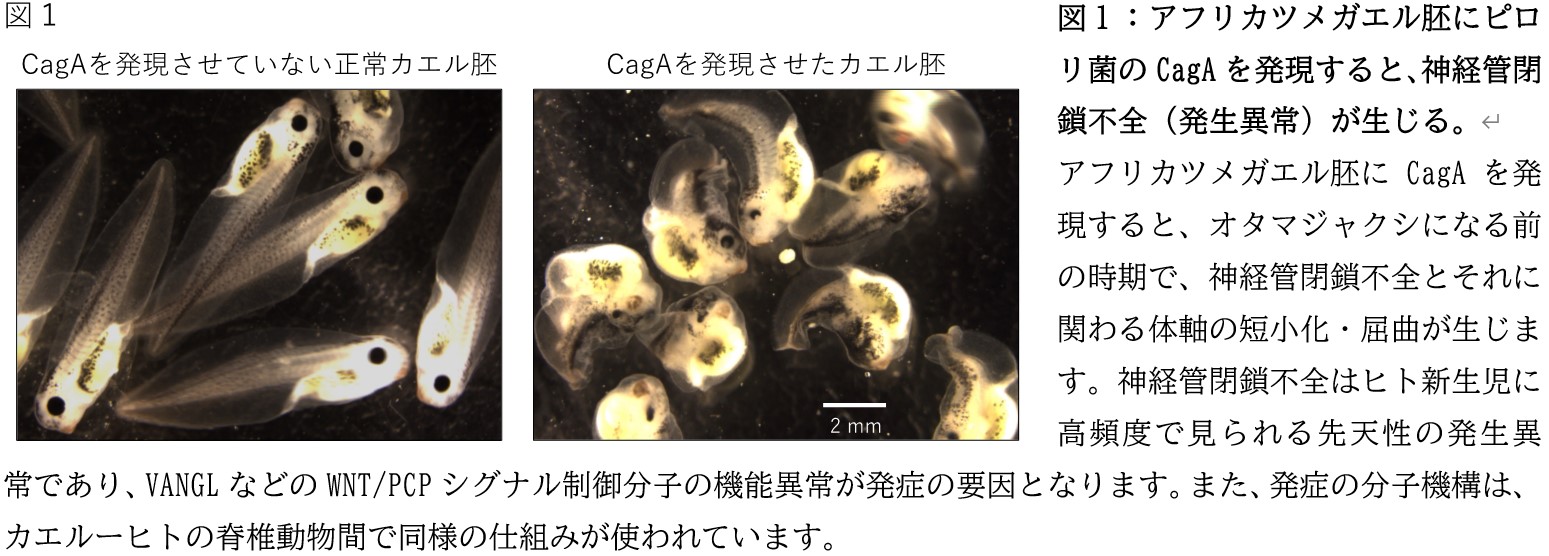
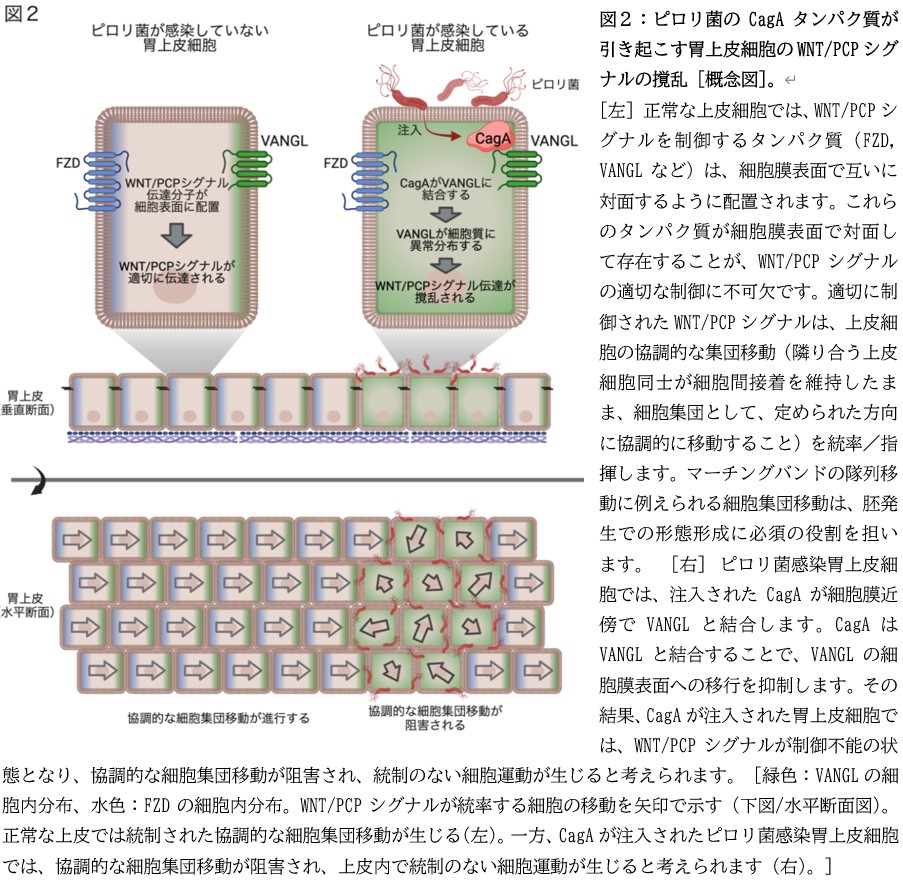
研究グループは、ピロリ菌のCagAタンパク質を発現したアフリカツメガエル胚が、神経管の閉鎖不全*7や体軸の屈曲・短小化といった発生異常を生じることを見出し(図1)、その原因がCagAによる細胞の集団移動*8の阻害であることを突き止めました。神経管閉鎖不全*7は、我が国で2000人の新生児に対して1例以上の割合で診断される最も一般的な先天性欠損症のひとつであり、協調的な細胞集団移動を司るWNT/ Planar Cell Polarity (PCP:平面内細胞極性)シグナル*9を制御する一群のタンパク質の機能異常が発症の要因となります。研究グループは、CagAを発現したカエル胚で観察された神経管閉鎖不全という形態異常を手がかりに、ヒト胃上皮細胞においてもCagAはWNT/PCPシグナルを撹乱すると予想しました。結果、ヒト胃上皮培養細胞に発現させたCagAが、N端側領域を介して、WNT/PCPシグナルを制御するタンパク質「Van Gogh-like (VANGL)*10」と細胞内で結合することを発見しました(図2)。VANGLは細胞膜に存在することで、細胞集団の協調的な移動を統率する機能を発揮します。研究グループは、機能不詳であったCagAのN端側領域がVANGL結合領域としてはたらき、VANGLの細胞膜表面への移行を抑制することを発見し、これがCagAによるWNT/PCPシグナル撹乱の原因であることを突き止めました(図2)。
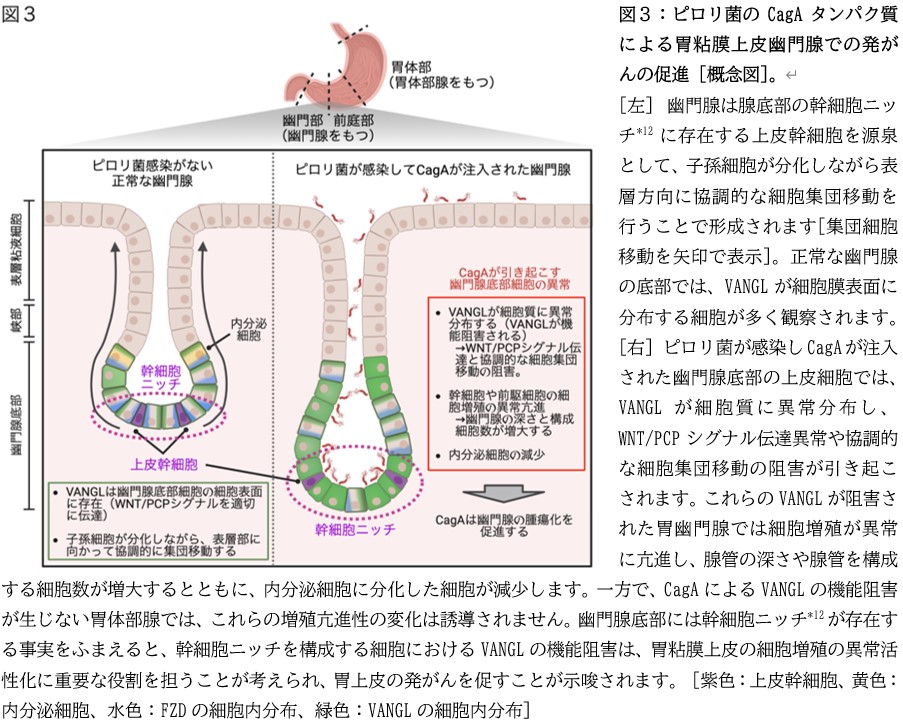
カエル胚やヒト胃上皮培養細胞で見出した、CagAが引き起こすVANGLの機能阻害(VANGLの細胞膜表面への移行の阻害)が、ピロリ菌感染による胃粘膜病変の発症にどのような役割をもつか明らかにするために、研究グループは、胃上皮細胞選択的にCagAを発現する遺伝子改変マウス*11を作製しました。このピロリ菌感染を模したマウスの胃の上皮細胞にCagAを発現すると、幹細胞ニッチ*12領域を含む胃幽門腺*4の底部で、VANGLが細胞膜から細胞質へと異常分布することを発見し、CagAがVANGLを機能阻害することをマウス生体の胃粘膜で明らかにしました(図3)。さらに研究グループは、CagAによりVANGLが機能阻害された幽門腺底部では、過剰な細胞増殖が引き起こされるとともに、分化した内分泌細胞が著しく減少していることも見出しました(図3)。一方、幽門腺とは対照的に、CagAによるVANGLの機能阻害が見られない胃体部腺*4では、CagAの発現は細胞増殖と細胞分化のいずれに対しても著明な影響を与えませんでした。
以上の結果から、研究グループは、ピロリ菌がんタンパク質CagAの新たな細胞内標的分子としてVANGLを同定し、CagAがVANGLと結合することで生じる WNT/PCPシグナルの撹乱が、胃幽門腺における幹細胞ニッチの形成に影響を与え、胃がん発症の母地となる胃上皮細胞の増殖・分化異常を引き起こすことを明らかにしました。
◆今後の展開
本研究成果により、胃がんが最も好発する胃幽門前庭部において、幹細胞の幹性維持、増殖・分化制御に、上皮細胞の平面内集団移動およびWNT/PCPシグナルが重要な役割を担うことが示唆されました。胃上皮や腸管上皮など、広範な上皮組織では、幹細胞ニッチ*12と呼ばれる上皮内の微小領域内で上皮幹細胞が適切な位置に配置されることが、上皮幹細胞の増殖や分化の適切な制御に不可欠と考えられています。したがって、様々な上皮組織においても、幹細胞の恒常性の維持に、WNT/PCPシグナルによる細胞集団移動の調節が重要な役割を担う可能性が推察され、同時にWNT/PCPシグナルの制御異常が種々の上皮組織において幹細胞の運命を変化させ、制御不能な細胞増殖を伴う「がん化」を促す可能性が考えられます。本成果を発端として、広範な上皮組織の「がん化」を抑制しうる、WNT/PCPシグナルを標的とした新たな医学・薬理学的介入法が開発されることに期待します。
◆共同研究グループ構成員(現所属機関)
- 金光 昌史 (順天堂大学大学院医学研究科 生化学・生体システム医科学, 助教) [筆頭著者]
- 盧 夢雪 (東京大学大学院医学系研究科 微生物学教室, 大学院生(当時)) [共筆頭著者]
- ナイト クリストファ 鷹也 (東京大学大学院医学系研究科 微生物学教室, 大学院生(当時))
- 山元 孝佳 (東京大学大学院総合文化研究科 生命環境科学 分子発生学, 助教)
- 林 大久生 (順天堂大学大学院医学研究科 人体病理病態学, 准教授)
- 三井 優輔 (基礎生物学研究所/生命創成探求センター 分子発生学, 助教;JST, さきがけ研究員)
- 大木 拓也 (微生物化学研究会 微生物化学研究所 第3生物活性研究部, 博士研究員)
- 菊地 逸平 (微生物化学研究会 微生物化学研究所 第3生物活性研究部, 研究員)
- 菊池 章 (大阪大学 感染症総合教育研究拠点CiDER, 特任教授)
- ニコラス バーカー (A*STAR Singapore, 教授;金沢大学 がん進展制御研究所 上皮幹細胞研究分野,
客員教授;National University of Singapore) - 洲﨑 悦生 (順天堂大学大学院医学研究科 生化学・生体システム医科学, 主任教授)
- 平良 眞規 (中央大学理工学部 生命科学科, 兼任講師)
-
畠山 昌則 (微生物化学研究会 微生物化学研究所 第3生物活性研究部, 部長、北海道大学 遺伝子病制
御研究所 感染癌研究センター, 特任教授) [研究責任者]
◆用語解説
*1 ヘリコバクター・ピロリ(ピロリ菌):世界人口の約半数の人の胃に慢性感染している細菌。ピロリ菌の感染は、WHOのIARC(国際がん研究機関)によって、最もリスクが高い「グループIの発がん因子」に規定されている。胃粘膜の中でも、特に胃酸分泌機能をもたない小腸側の幽門腺領域により多く棲息する。
*2 CagAタンパク質 [キャグエー]:ピロリ菌がヒトの胃上皮細胞に注入するタンパク質。ヒト胃上皮細胞内に存在するタンパク質と結合して、その機能を撹乱することで発がんを促進する。細菌由来のがんタンパク質として知られる。
*3 細胞内シグナル(伝達):細胞膜表面の受容体分子で細胞外のシグナル(情報)を受け取り、細胞内の伝達分子によるリレーを介して、細胞内の作業分子(エフェクター)の機能や発現を調節する仕組み。細胞内シグナル伝達の破綻は、がんを含む様々な疾患の発症要因となる。
*4 幽門腺・胃体部腺:ヒトの胃粘膜は、胃酸分泌機能をもつ胃体部と、胃酸分泌機能をもたない前庭部・幽門部に大別されます。胃体部の上皮は胃体部腺と呼ばれる胃酸分泌腺を形成し、前庭部や幽門部の上皮は幽門腺から構成されます(図3)。幽門腺の底部には幹細胞ニッチ*12と呼ばれる微小領域があり、ここに上皮幹細胞が存在します。幹細胞から生じた未熟な子孫細胞(前駆細胞)は、腺を構成する上皮細胞平面を胃の表層に向かい一方向性に協調的な集団移動を繰り返して上進し、その過程で内分泌機能などをもつ各種細胞に分化します。上皮幹細胞や前駆細胞の細胞増殖が制御不能な状態で活性化すると、発がんの原因となることが知られている。
*5 アフリカツメガエル:生物学の研究で広く用いられる実験動物のひとつ。特に、発生生物学の研究で広く解析対象として用いられているため、1つの受精卵がどのように細胞分裂・細胞分化・細胞移動を繰り返し、胚や幼生が形態形成されていくのかが、分子レベルで理解されている。発生異常胚の形態(奇形)を解析することで、その原因となる分子機能の異常やシグナル伝達の異常を推察することができる(図1)。
*6 胚、胚発生:多細胞生物の個体発生におけるごく初期の段階の個体のこと。受精直後から細胞増殖・細胞分化・細胞移動を繰り返して、組織や器官などの身体の構造や形態が形成されるプロセスを、胚の発生(胚発生)と呼びます。
*7 神経管閉鎖不全(Neural tube (closure) defect):脊椎動物の胚発生の過程で、神経管(脊髄のもととなる構造物)の形成不良が生じること。VANGLやFZDに代表されるWNT/PCPシグナル制御分子の機能異常によって、神経管の閉鎖を目的とした神経板上皮細胞の集団移動が阻害されることが主な要因となる(図1)。
*8 上皮細胞の集団移動(Collective cell migration):上皮細胞で構成された上皮細胞平面内を、複数の上皮細胞が細胞間接着を維持したまま、一方向性かつ協調的に細胞集団として移動すること(図2)。胚発生における形態形成に必須の役割をもつ。移動の方向や速度はWNT/PCPシグナル伝達によって制御されている。細胞集団移動はマーチングバンドの隊列移動に例えられ、その場合、WNT/PCPシグナルは統率者/指揮者として理解することができる。
*9 WNT/PCP(Planar cell polarity=平面内細胞極性)シグナル伝達 [ウィント/ピーシーピー]:上皮細胞平面内に存在する細胞集団をある秩序にもとづいて集団移動する際に使われる細胞内シグナルの仕組み。胚発生において、形態形成を担う集団細胞移動で不可欠な役割をもつ。対面する側方の細胞膜のそれぞれにVANGLやFZDなどの分子が向かい合って配置されることが、WNT/PCPシグナル伝達や細胞の集団移動の制御に必要と考えられている(図2)。
*10 VANGL [ヴァングル](Van Gogh-like):WNT/PCPシグナルを制御する主要分子の1つ。細胞膜貫通型の足場タンパク質であり、細胞膜上でWNT/PCPシグナル伝達の制御を行う。VANGL遺伝子の先天性の機能欠損型変異は、ヒト・マウス・カエルなどの脊椎動物において神経管閉鎖不全の原因となる。ヒトのVANGL遺伝子は、ハエの祖先遺伝子Vang (Van Gogh)と相同の機能をもつ。Vang遺伝子に機能異常をもつハエでは、羽根の微毛がVan Gogh(ゴッホ)の絵画の筆使いを想起させるような異常な毛並みとなることから、Vang(Van Gogh)あるいはVANGL(Van Gogh-like)と命名されています。
*11 遺伝子改変マウス:人工的な操作によって外来性の遺伝子がゲノム内に導入されたマウスのこと。本研究の場合は、ピロリ菌のcagA遺伝子がゲノム内に人為的に挿入されたマウスES細胞をもとに得られた新生マウスのことを指す。
*12 幹細胞ニッチ(Stem cell niche):幹細胞が生育するための上皮内の微小領域(ゆりかご)。幹細胞や未分化性の子孫細胞(前駆細胞)が、それらの細胞の複製・分裂・分化を調節する種々の機能性細胞と近接して形成される微小領域のこと。胃粘膜幽門腺では腺管底部に存在する(図3)。幹細胞は、どのような機能性細胞が隣り合うかによって、その後の運命(増殖/分化など)が決まるため、幹細胞ニッチ内で幹細胞が適切な位置に配置されることが、胃上皮の恒常性維持に必須である。幹細胞あるいは幹細胞ニッチの機能異常は、上皮細胞の増殖/分化の脱制御を引き起こし、がんなどの疾患の発症要因となる。
研究者のコメント
ピロリ菌はヒトの胃粘膜に安定的に接着して感染する一方、マウスの胃粘膜への接着は弱く安定的な感染が成立しません。したがって、ピロリ菌感染が引き起こすヒトの胃の病態を、マウスを宿主とするピロリ菌感染実験で模倣することは困難です。この問題点を克服するために、研究グループは、胃上皮細胞選択的にCagAを発現する遺伝子改変マウスを世界に先駆けて作製しました。胃粘膜幽門腺の上皮細胞で、CagAが実際にWNT/PCPシグナルを撹乱し、細胞増殖を過剰活性化した観察結果は、このマウスモデル以外の実験系では取得することができません。当該研究領域の国際的な競合の中でも、研究グループの優位性を示す新規知見です。
◆原著論文
タイトル:The Helicobacter pylori CagA oncoprotein disrupts Wnt/PCP signaling and promotes hyperproliferation of pyloric gland base cells.
タイトル(日本語訳):ヘリコバクター・ピロリのがんタンパク質CagAは、Wnt/PCPシグナル伝達を脱制御し、幽門腺底部で細胞増殖を異常亢進する。
著者:Atsushi Takahashi-Kanemitsu1,2,†, Mengxue Lu1,†, Christopher Takaya Knight1, Takayoshi Yamamoto3,4, Takuo Hayashi5, Yusuke Mii6,7, Takuya Ooki1,8, Ippei Kikuchi1,8, Akira Kikuchi9,10, Nick Barker11,12,13, Etsuo A. Susaki2, Masanori Taira3,14, and Masanori Hatakeyama1,8,15*
著者(日本語表記):金光(髙橋) 昌史1,2,†、盧 夢雪1,†、ナイト クリストファ鷹也1、山元 孝佳3,4、林 大久生5、三井 優輔6,7、大木 拓也1,8、菊地 逸平1,8、菊池 章9,10、バーカー ニコラス11,12,13、洲﨑 悦生2、平良 眞規3,14、畠山 昌則1,8,15* (†筆頭著者、*研究責任者)
著者所属:1東京大学・大学院医学系研究科・微生物学(当時)、2順天堂大学・大学院医学研究科・生化学 生体システム医科学、3東京大学・大学院理学系研究科・分子生物学(当時)、4東京大学・大学院総合文化研究科・生命環境科学・分子発生学、5順天堂大学・大学院医学研究科・人体病理病態学、6基礎生物学研究所/ExCELLS・分子発生学、7JSTさきがけ、8微生物化学研究会・微生物化学研究所・第3生物活性、9大阪大学・大学院医学系研究科・分子病態生化学(当時)、10大阪大学・感染症総合教育研究拠点CiDER、11 Inst. Molecular and Cell Biology・A*STAR・Singapore、12Dept. Physiology・Yong Loo Lin Sch. Medicine・National University of Singapore、13金沢大学・がん進展制御研究所・上皮幹細胞、14中央大学・理工学部・生物科学、15北海道大学・遺伝子病制御研究所・感染癌研究センター
DOI:10.1126/scisignal.abp9020
本研究はJSPS科学研究費補助金(16H06373, 21H04804, 19K05945, 22H02824, 25251026)、AMED次世代がん医療創生研究事業P-CREATE(160200000291, JP22ama221517)、JSTさきがけPRESTO(JPMJPR194B)および北海道大学遺伝子病制御研究所・共同研究拠点、日本私立学校振興共済事業団の支援を受け、多施設による共同研究として実施されました。本研究の遂行にご協力いただきました全ての皆様および実験動物に、心より深く感謝を申し上げます。