JUNTENDO News&Events ニュース&イベント
2023.09.14 (THU)
- 順天堂大学について
- 受験生の方へ
- 学校・塾の関係者の方へ
- メディアの方へ
- 医学部
新たなNLRP1インフラマソーム活性抑制因子チオレドキシンの発見と構造解明 ――自己炎症性疾患等の新規治療薬開発に道――
順天堂大学大学院医学研究科アトピー疾患研究センターの北浦次郎 教授、東京大学大学院薬学系研究科の張志寛 助教、藤村亜紀子 特任研究員、大戸梅治 准教授、清水敏之 教授、同大学医科学研究所の柴田琢磨 准教授、三宅健介 教授らの共同研究チームは、クライオ電子顕微鏡単粒子解析を通して、NLRP1インフラマソーム(注1)活性化の新たな抑制因子としてチオレドキシン(TRX)(注2)を同定し、さらにNLRP1とTRXとの複合体の構造を解明しました。生体の酸化還元状態の制御に重要な働きを示すTRXが直接結合することによって自然免疫応答を制御することは、酸化還元状態と自然免疫との関連性が重要であることを意味します。ここで得られた構造知見はNLRP1が関与する疾患をターゲットとする治療薬の開発にも大きく貢献することが期待されます。本研究成果は2023 年 9月13日付でNatureに掲載されました。
発表のポイント
- インフラマソーム構成分子の1つであるNLRP1(NLR family pyrin domain containing 1)は、近年自己炎症性疾患に関連することから注目されているが、クライオ電子顕微鏡構造解析により、全ての生物に共通してみられるチオレドキシン(TRX)がNLRP1の新たな結合因子であることを発見した。
- 酸化還元活性を持つTRXのシステインがNLRP1への結合に重要な役割を果たしており、TRXがNLRP1インフラマソームの活性化を抑制することを明らかにした。
- 研究によって得られた構造的知見は、 NLRP1が関与する自己炎症性疾患などの新規治療薬開発に大きく貢献することが期待される。
◆発表内容
【研究の背景】
NOD様受容体(NLR)は細胞質に発現する自然免疫受容体です。これらの受容体は、細菌やウイルスなどの病原体関連分子パターンや細胞自体から放出されるダメージ関連分子パターンを認識することによって活性化され、炎症性サイトカイン(注3)やインターフェロン(注4)の産生を誘導します。NLRP1はインフラマソームとして知られるタンパク質複合体を形成する最初のNLRとして同定されました。NLRP1の活性化は多様な活性化因子および抑制因子によって制御されており、NLRP1インフラマソーム機能は様々な自己炎症性疾患やがんの発症と関連しています。本研究チームは、NLRP1の活性化と制御メカニズムの解明を目指して研究を進めてきました。
【研究の内容】
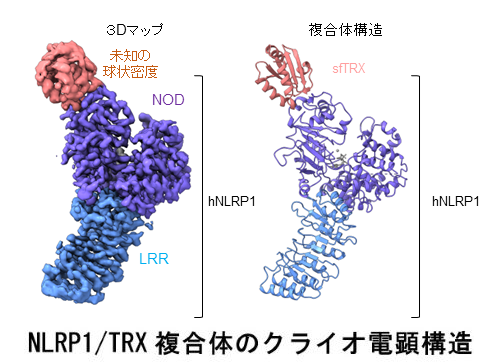
NLRP1は複数のドメインからなるタンパク質です(図1)。本研究チームは、昆虫細胞から組み換えヒトNLRP1タンパク質を高純度に精製することに成功しました。NODドメインとLRRドメインを含むNLRP1タンパク質の精製試料をクライオ電子顕微鏡単粒子解析(注5)により構造決定した結果、驚くべきことに、NLRP1のNODドメイン中のNBDサブドメインに隣接して、NLRP1の未知の結合因子の存在を示唆するNLRP1に由来しない密度が観察されました(図1左下)。NLRP1タンパク質試料をSDS-PAGEおよび質量分析を用いて精査した結果、これは昆虫細胞由来のチオレドキシン(TRX)がNLRP1と共精製されたものであることが判明しました。さらに、ヒト由来の組み換えTRXタンパク質を用いてin vitroのプルダウンアッセイ(注6)を行った結果、TRXはNLRP1と特異的かつ強固に結合することが示されました。これにより、TRXが新たなNLRP1結合因子であることが明らかになりました。
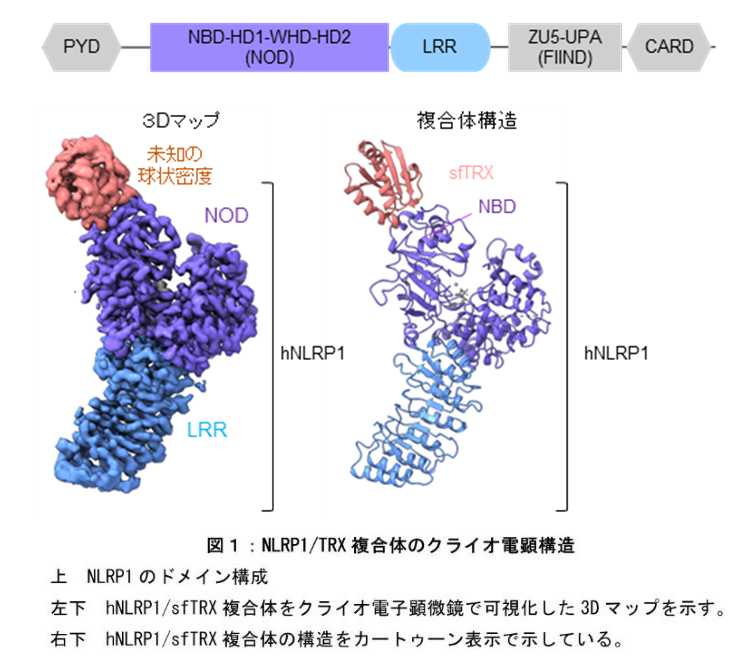
TRXは、NLRP1のNBDサブドメインと相互作用し、疎水的な結合界面を形成していました。興味深いことに、TRXの酸化還元反応に重要な2つのシステイン残基(C32とC35)は、NLRP1との結合界面の中央に位置していました。また、結合界面のNLRP1側にも1つのシステイン残基(C427)が存在していました。TRXの2つのシステイン残基はジスルフィド結合を形成しており酸化状態のTRXがNLRP1と結合していました。一連の生化学実験により、これら3つのシステイン残基がTRXとNLRP1の複合体形成において重要な役割を果たすことが示されました。
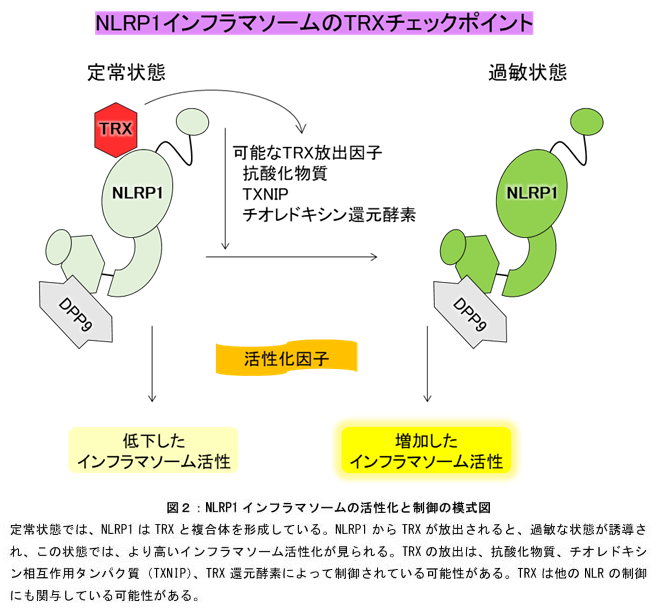
さらに研究チームはNLRP1とTRXの相互作用の機能的な役割について調べました。HEK293T細胞およびヒト角化細胞における、TRXノックアウト、ノックダウン、および変異体解析の結果、内因性のTRXの減少やNLRP1とTRXの結合部位の変異によりNLRP1のインフラマソーム活性化が亢進することが明らかになりました。これらの結果により、TRXがNLRP1インフラマソームを直接的に抑制することが明らかになりました。(図2)
【今後の展望】
本研究では、生体の恒常性維持に重要なインフラマソーム構成因子であるNLRP1の新たな抑制因子であるTRXを同定し、さらにその分子レベルでの相互作用を解明しました。TRXは、ほぼすべての生物に普遍的に存在し、生体の酸化還元状態の制御システムを構成する重要な分子です。この酸化還元システムが、自然免疫受容体の活性を直接的に制御していることは、生命の驚くべき仕組みの一端を示しています。本研究によるTRXと自然免疫系の相互作用の理解は、NLRP1に関連する疾患への新たな治療アプローチを開拓する可能性を秘めています。
◆論文情報
〈雑誌〉 Nature
〈題名〉 Structural basis for thioredoxin-mediated suppression of NLRP1 inflammasome
〈著者〉 Zhikuan Zhang*, Takuma Shibata*, Akiko Fujimura, Jiro Kitaura, Kensuke Miyake, Umeharu Ohto† and Toshiyuki Shimizu† (*co-first authors, †co-corresponding authors)
〈DOI〉 10.1038/s41586-023-06532-4
〈URL〉 https://www.nature.com/articles/s41586-023-06532-4
◆研究助成
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「細胞内現象の時空間ダイナミクス」研究領域 研究課題名「Toll様受容体の応答を決定する時空間リソソームダイナミクス」(課題番号:JPMJCR21E4 研究代表者:清水敏之)を始め、文部科学省 科学研究費補助金(課題番号22K15046, 20K15730, 22H02556, 23K18211, 23H00366)、AMED創薬等先端技術支援プラットフォーム(BINDS)などの外部資金支援を受けて行われたものです。
◆用語解説
(注1)インフラマソーム(Inflammasome)
免疫応答における重要な役割を果たす分子複合体である。インフラマソームセンサーは細胞内に侵入した病原体または細胞が受けた損傷などを検出し、主にカスパーゼ-1を活性化させることによって、炎症性サイトカインであるインターロイキン-1βとインターロイキン-18の生成を促進する。これにより、免疫応答が活性化され、感染症や組織損傷に対する適切な炎症応答が引き起こされる。
(注2)チオレドキシン
全ての生物に存在する低分子量の酸化還元タンパク質。生体の酸化還元状態を制御することによって、さまざまな生命反応において重要な役割を担っている。
(注3)炎症性サイトカイン
サイトカインとは、細胞同士の情報伝達にかかわるさまざまな生理活性を持つタンパク質の総称。炎症性サイトカインとは、体内への病原体の侵入を受けて産生されるサイトカインで、生体防御に関与する多種類の細胞に働き、炎症反応を引き起こす。
(注4)インターフェロン
細菌やウイルスなどの病原体の侵入に対して免疫系の細胞が分泌するタンパク質で、ウイルスの増殖を抑制する作用や免疫系を活性化する作用を発揮する。
(注5)クライオ電子顕微鏡単粒子解析
タンパク質の立体構造を高分解能で決定するための手法の1つ。電子線照射による分子の振動や損傷を抑えるために、観測対象のタンパク質を氷薄膜中に包埋し、マイナス 180 度の低温に保ったまま電子顕微鏡像を観測する。数十万から数百万分子の投影像を分類・平均化し、それらを統合して高分解能の三次元構造を構築する。
(注6)プルダウンアッセイ
相互作用タンパク質を検出する方法。タグ付きタンパク質(ベイト)を担体に固定化し、ベイトと相互作用する(結合する)タンパク質を検出する。
※本リリ-スの原本は以下のリンクからご覧になれます。