JUNTENDO News&Events ニュース&イベント
2024.09.25 (WED)
- 順天堂大学について
- 研究活動
- メディアの方へ
- 企業・研究者の方へ
- 医学部
- 医学研究科
糖尿病を遠ざけるキネシン-1分子モーター ―血糖調節の新たな細胞内機構―
発表のポイント
◆細胞内の貨物列車、キネシン-1 分子モーターが血糖を調節し、糖尿病を予防する機構をマウスを使った研究により解明しました。
◆膵β細胞においてキネシン-1 分子モーターが、粗面小胞体で翻訳されたカルシウムチャネル蛋白質を正しく折り畳み、インスリン分泌を促進して血糖恒常性を保つことを発見しました。
◆キネシン分子モーターの蛋白質折り畳み機能への新たな関与の発見によって、小胞体ダイナミクスの謎が解き明かされ、糖尿病の新たな治療法開発に道を開きました。
小胞体におけるシャペロン交換による糖尿病の抑制機構
■概要
順天堂大学大学院医学研究科・東京大学大学院医学系研究科の研究グループは、糖尿病を予防する新たな分子機構を発見しました。
キネシン-1 分子モーターは、血糖恒常性の維持に欠かせないインスリンを産生する膵β細胞に多く発現されています。この膵β細胞においてキネシン-1 分子モーターを欠損させたマウスは、血糖上昇時のインスリン分泌能が低下し、高血糖となりました。超解像顕微鏡(注1)等を用いた集学的解析により、キネシン-1 分子モーターによるインスリン分泌促進機構を世界で初めて解明しました。キネシン-1 分子モーターは、小胞体膜上でシャペロン蛋白質の働きを直接制御し、カルシウムチャネル蛋白質を正しく折り畳みます。そしてこのカルシウムチャネルの機能によってインスリン分泌が促進されるという細胞メカニズムを発見した点で新規性があり、この研究成果は今後糖尿病の治療法開発に大きく役立つことが期待されます。
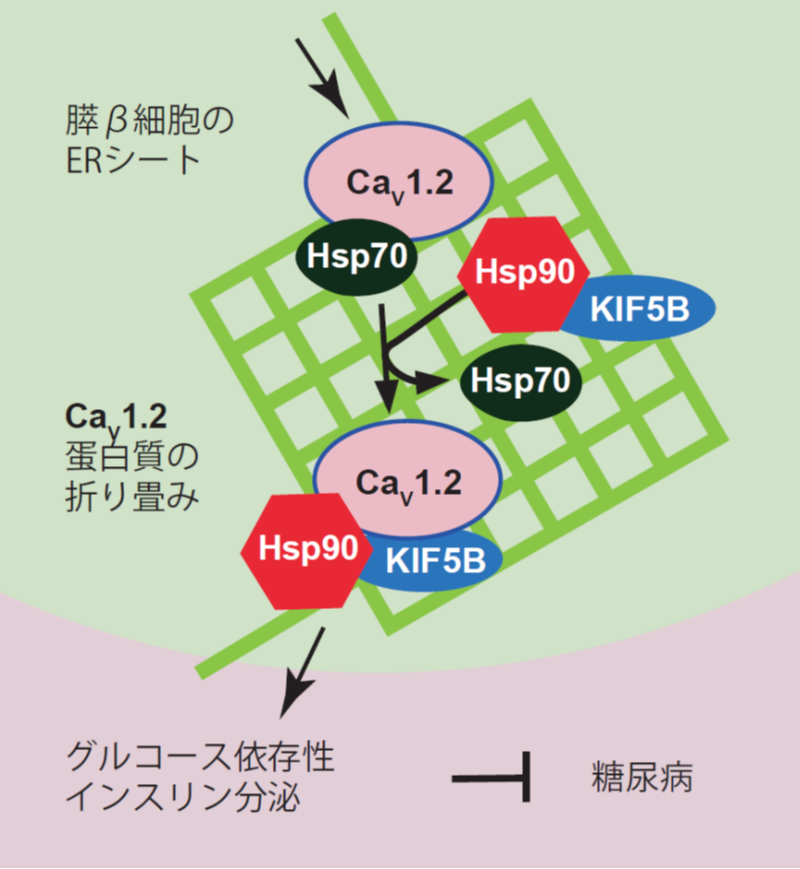
図1:キネシン-1分子モーターKIF5Bの新たな抗糖尿病メカニズム
膵β細胞の小胞体のER シートにおいて、キネシン-1 蛋白質が電位依存性カルシウムチャネル蛋白質CaV1.2の折り畳みのためのHsp70 からHsp90 へのシャペロン交換を促進し、インスリン分泌を促進することを発見した。
■発表内容
膵β細胞は、食後の血糖の上昇によりインスリン分泌を数時間にわたり促進し(注2)、血糖の恒常性の維持に必須な役割をもっています。糖尿病ではこのインスリン分泌機構が破綻して血糖が上昇してしまいますが、血糖がインスリン分泌をどのように促進するのか、あるいはどのような細胞内機構がインスリン分泌を制御するのかには、不明な部分が多くあります。キネシン分子モーター (KIFs) (注3)は、細胞内の微小管に沿ってオルガネラ等を輸送する分子モーターの一群です。これまでの先行研究ではキネシン-1 分子モーター KIF5B 遺伝子のインスリン分泌第二相における意義が示唆されていましたが、その分子メカニズムはまったく分かっていませんでした。特に、キネシン-1 分子モーターがインスリン顆粒を直接運び、細胞膜直下へと供給しているのかが焦点になっていました。この度、本研究チームがキネシン-1を欠損したモデルマウス(注4)の膵β細胞において、高速共焦点レーザ顕微鏡等を用いてインスリン顆粒をナノ計測(注5)したところ、➊超短距離の輸送は減少しているが ➋長距離の輸送は逆に活発となり ➌細胞膜へのドッキング放出の安定性が損なわれている との興味深い結果が出ました。
キネシン-1 欠損膵β細胞ではグルコースに応答した ➀細胞内カルシウム濃度の上昇と、その下流の ➁アクチン細胞骨格の再調整 が起こらなくなっていました。そこで薬剤を使って、この ➀ または ➁ を強制的に起こすと、前述 ➊~➌ のインスリン顆粒ダイナミクスの異常が回復しました。したがって、キネシン-1 はカルシウム-アクチン系の作用を通して間接的にインスリン分泌を制御していることがわかりました。
ここで超解像顕微鏡の観察を行うと、キネシン-1 と電位依存性カルシウムチャネルCaV1.2(注6)は細胞内の網目状の構造に共局在しており、キネシン欠損細胞ではCaV1.2 の発現が顕著に低下していました。そこで研究チームは小胞体に目を向け、世界で初めて小胞体におけるCaV1.2 蛋白質のシャペロン依存性の折り畳み機構(注7)にキネシン-1 分子モーターが必須な役割を果たしていることを発見しました。またこの現象がER シート(注8)という特殊な小胞体の上で特に起こりやすいことも発見しました。実際、キネシン-1 分子モーターとHsc70 シャペロンを細胞に同時に発現すると、膵β細胞のインスリン分泌機能を増強するCaV1.2 蛋白質の量が増加することを確認できました。
20 年にわたる研究の成果で、糖尿病を予防するキネシン-1 分子モーターの新しい役割が確認されましたが、これは糖尿病の治療法開発のような社会への波及効果と、細胞生物学の発展に寄与することが期待されます。
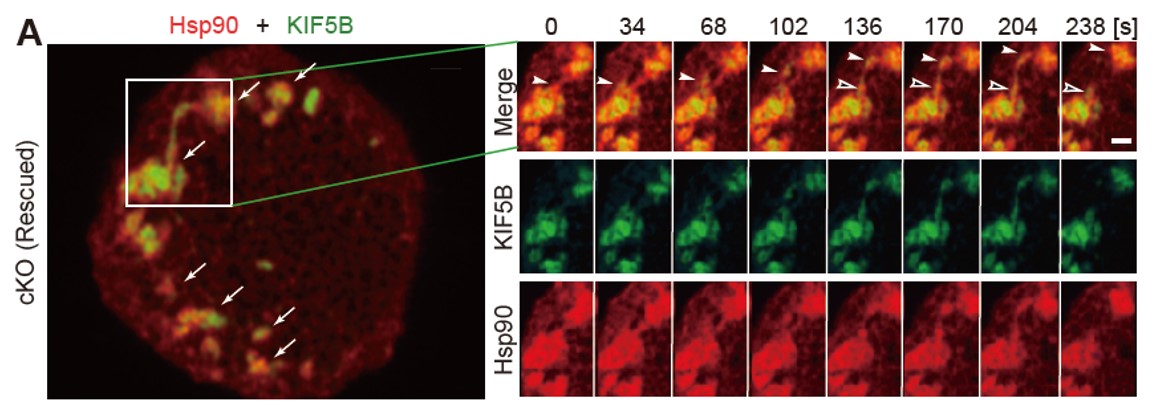
図2:キネシン-1(緑)とHsp90(赤)の共局在を示すAiryscan顕微鏡のライブイメージング
初代培養したマウス膵β細胞の底面における両者の共局在とダイナミクス。
〇関連情報:
「脂肪のとりすぎによる2型糖尿病にも胃薬は効くか?——分子モーター研究が拓く新たな糖尿病臨床——」(2014/12/4)
https://www.u-tokyo.ac.jp/focus/ja/articles/a_00327.html
■発表者・研究者等情報
東京大学
大学院医学系研究科 分子細胞生物学専攻
田中 庸介 講師
Atena Farkhondeh 研究当時:特任研究員
楊 文星 研究当時:特任研究員
上野 仁之 研究当時:特任研究員
国際医療福祉大学
市川病院 糖尿病・代謝・内分泌内科
野田 光彦 病院教授
兼:埼玉医科大学客員教授
順天堂大学
大学院医学研究科
廣川 信隆 特任教授
兼:東京大学名誉教授・客員研究員
研究当時:東京大学大学院医学系研究科 分子細胞生物学専攻 教授・特任教授
■論文情報
雑誌名:EMBO Reports
題 名:Kinesin-1 mediates proper ER folding of the CaV1.2 channel and maintains mouse glucose homeostasis
著者名:Yosuke Tanaka, Atena Farkhondeh, Wenxing Yang, Hitoshi Ueno, Mitsuhiko Noda & Nobutaka Hirokawa*
DOI: 10.1038/s44319-024-00246-y
URL: https://doi.org/10.1038/s44319-024-00246-y
■研究助成
本研究は、科研費「キネシンモーター分子群による細胞内輸送機構の分子機構:構造・機能・動態及び制御(課題番号18002013)」(廣川)、「キネシンモーター分子群の機能と制御の統合生物学的研究(課題番号:JP23000013)」(廣川)、「キネシンモーター分子群による脳神経機能および発生の制御の統合的研究(課題番号:JP16H06372)」(廣川)、「糖尿病を予防するキネシン分子モーターによる蛋白質品質管理の空間的制御機構の解明(課題番号:JP20K06634)」(田中)、日本電子寄附金(廣川)、上原記念生命科学財団研究助成金「キネシンモーターのかかわる代謝疾患の分子機構の解析」(田中)、小野医学研究財団研究助成金「キネシンモーターのかかわる非アルコール性肝障害の分子機構の解析」(田中)、日本IDDM ネットワーク研究助成金「キネシンによってシャペロン蛋白の局在を整える新しい抗糖尿病戦略の開発」(田中)の支援により実施されました。
■用語解説
(注1)超解像顕微鏡
光の波長以下の微細な構造は光学顕微鏡では原理的に観察できないとされていますが、これを特殊な方法で観察可能にした顕微鏡です。本研究では多数回の繰り返し撮像により解像度を上げる光活性化局在性顕微鏡法(PALM/STORM 法)や32 個の検出器の同時計測を用いたAiryscan顕微鏡法を用いました。
(注2)膵β細胞からのインスリン分泌
糖尿病におけるもっとも重要なターゲットの一つです。インスリンは筋肉や肝臓に働きかけて血糖を低下させるホルモンですが、その分泌不全により高血糖状態が続くと、神経・腎臓・網膜等の細胞が異常をきたします。グルコースを膵β細胞に付加すると、その代謝によりATP/ADP 比が上昇しKATP チャネルが閉鎖して細胞膜が電気的に興奮します。すると電位依存性カルシウムチャネル(注6)が開口して細胞内にカルシウムイオンが流入し、その影響によりインスリン顆粒が細胞膜とドッキングしてインスリンが開口放出されます。グルコース負荷後10 分以内に大量に放出される第一相と、10-60 分に緩徐に放出される第二相に分類することができます。特に第二相の発現には、カルシウム依存性のアクチン細胞骨格の再調整が必要であるとされていますが、その細部には不明な点が多くあります。本研究では、キネシン-1 分子モーターが電位依存性カルシウムチャネルの発現を通して第二相のインスリン分泌を維持する新しい機構を解明することができました。
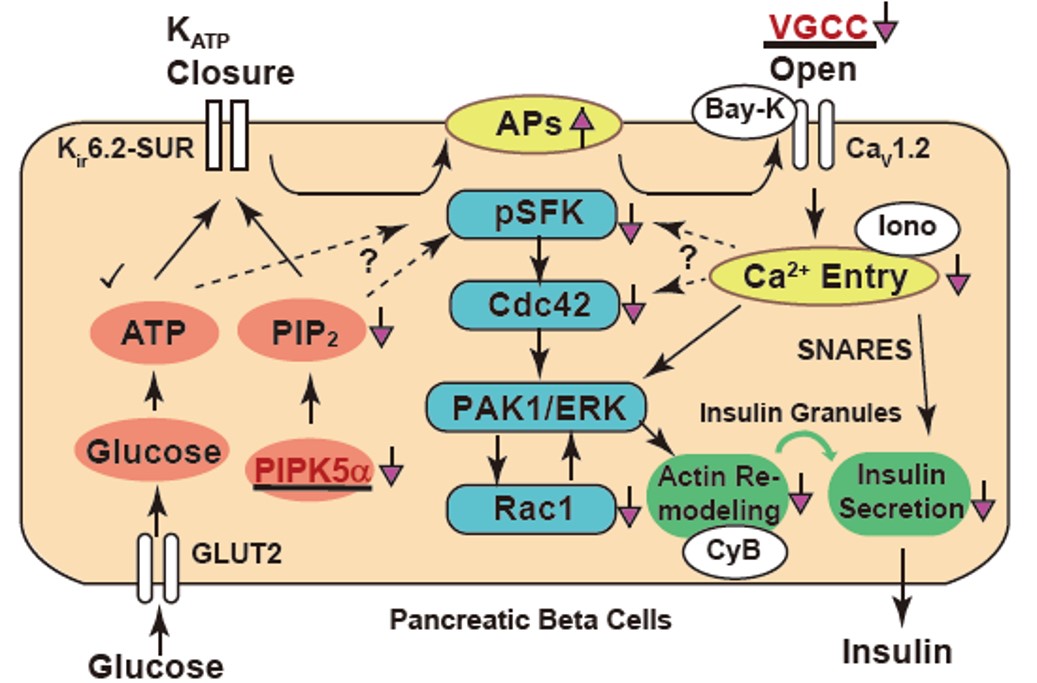
図3:膵β細胞におけるグルコース依存性インスリン分泌のシグナル伝達の全体像
キネシン-1欠損細胞では CaV1.2 ならびに PIPK5α蛋白質の発現が低下し、さまざまなシグナル伝達に影響が出ている。
(注3)キネシン分子モーター (KIFs)
細胞内の物質輸送は、微小管系の細胞骨格をレールとしたキネシン分子モーターと細胞質ダイニン、アクチン系の細胞骨格をレールとしたミオシン分子モーターによって分担されています。研究チームは、1990 年代初頭に45 種類のキネシン分子モーター全てを同定し、1990 年代後半から2020 年代初頭にかけて主なキネシン分子モーターについて遺伝子欠損マウスを作成し、その表現型を解析しました。これまでに、統合失調症、糖尿病、神経難病、てんかん、脳腫瘍、PTSD、疼痛、左右逆位、多指症などのヒト疾患モデルマウスを得ており、その基盤となる新規分子機構を解明することができました。糖尿病に関しては脂肪のとりすぎにより KIF12が減少し、Hsc70 が減少して膵β細胞の機能低下がもたらされることを以前に示しています
(「関連情報」参照)。
(注4)キネシン-1 を欠損したモデルマウス
キネシン-1 を全身で欠損させたマウスは初期胚の重篤な奇形のため流産してしまいました(Tanaka et al., Cell 1998)。したがってここでは Cre/loxP 法を用いて、インスリンを発現する膵β細胞のみでキネシン-1 Kif5b 遺伝子を欠損するマウスを構築しました。まずKif5b遺伝子の一部に loxP サイトを標的遺伝子組換えにより導入しておきます。次に、膵β細胞でのみ Cre 酵素を発現しているトランスジェニックマウスとこれを掛け合わせました。すると、膵β細胞においてのみ loxP サイト間の組換えが生じて Kif5b 遺伝子が破壊される「条件的ノックアウトマウス」を作ることができました。このマウスはグルコース負荷によっても十分にインスリンが放出できず、耐糖能異常を示す糖尿病のモデルマウスとなりました。
(注5)インスリン顆粒のナノ計測
膵β細胞のインスリン顆粒をSynapto.pHluorin ならびに Phogrin-EGFP と呼ばれる組換えタンパク質の蛍光プローブで生染色し、細胞表面におけるその様相を全反射顕微鏡や高速共焦点レーザ顕微鏡などを用いて時間観察し、その動きのパラメータを算出して比較しました。前者の観察では、細胞表面への開口放出の時間相に関して主に解析し、キネシン-1 欠損細胞では長距離輸送が活発となり、細胞膜へのドッキング放出の安定性が損なわれていることを同定しました。後者の観察では、平均二乗変位解析を行ったところ、キネシン-1 欠損細胞では短距離輸送がほぼ廃絶していることが解明されました。これら全部の表現型はアクチン細胞骨格の調整剤サイトカラシンBにより回復したため、アクチン細胞骨格はミオシン分子モーターによるインスリン顆粒の短距離輸送を担うとともに、細胞表面へのドッキングによる安定した開口放出を阻害するという二つの作用があり、キネシン-1 はアクチン細胞骨格の再調整を通して、イ
ンスリン顆粒のふるまいを間接的に調節しているということが明らかとなりました。
(注6)電位依存性カルシウムチャネルCaV1.2
グルコース依存性インスリン分泌第二相のメインルートである細胞内カルシウム濃度の上昇を主に担う細胞表面蛋白質で、本研究ではキネシン-1 の欠損により蛋白質レベルで顕著に発現量が低下することが明らかになりました。その結果、グルコース刺激時における細胞膜のカルシウム電流が顕著に低下し、カルシウム濃度の増加がほぼ廃絶していました。またCaV1.2 チャネルはBKCa チャネルを直接制御して静止膜電位を過分極させることが知られており、キネシン-1 欠損細胞ではこの効果により静止膜電位が脱分極し、インスリン分泌の基底レベルが上昇していました。そのアゴニストである Bay-K 8644 をキネシン-1 欠損マウス膵島に作用させると、グルコース依存性のインスリン放出を約8倍の量に復活することができたため、本蛋白質の機能がキネシン-1 分子モーターの膵β細胞インスリン分泌におけるメインの作用を構成していると考えました。
(注7)シャペロン依存性の蛋白質折り畳み機構
CaV1.2 などの膜蛋白質の翻訳は、粗面小胞体と呼ばれる枝分かれした細胞内小器官において主に行われます。その後、シャペロンと呼ばれるヘルパー蛋白質の作用で、小胞体内で徐々に膜蛋白質の折り畳みが起こり、最終的にはゴルジ装置を経て細胞膜に運ばれます。CaV1.2 は最初 Hsc70/Hsp70 シャペロンにより折り畳まれ、うまく折り畳めないと蛋白分解経路に送られてしまうことがわかりました。その後、キネシン-1 と STIP1 蛋白質の相互作用によってシャペロン交換が起こり、Hsp90 シャペロンにより後半戦の折り畳みが生じます。野生型の細胞で生化学的・形態学的に解析すると、CaV1.2 は Hsc70 と Hsp90 の両者のシャペロンと結合していました。しかし、キネシン-1 欠損細胞では、CaV1.2 は Hsc70 としか結合しなくなりました。すなわち、シャペロン交換による CaV1.2 蛋白質の折り畳みの品質管理機構にキネシン-1が重要な役割を果たしていることが示唆されました。一方、CaV1.2 蛋白質と拮抗する作用を持つ KATP チャネル蛋白質は Hsc70 シャペロンのみによって折り畳まれていました。したがってキネシン-1 を欠損してもその発現量に影響はありませんでした。このようにキネシン-1 による Hsp90 シャペロンの小胞体へのリクルートにより、ある一部の膜蛋白質だけが影響を受ける新しい制御機構の存在が明らかとなりました。
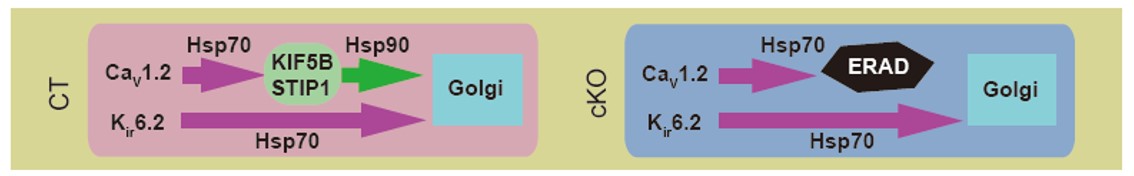
図4:キネシン-1(KIF5B)依存性のシャペロン交換の模式図
CaV1.2蛋白質の折り畳みにはキネシン-1依存性のシャペロン交換を必要とするがKATPチャネルKir6.2蛋白質の場合には必要がない。
(注8)ER シート
小胞体 (ER) は細胞内の枝分かれした膜小器官の連続体ですが、ER 槽と呼ばれる枝分かれした細い網目状の部分と、ER シートと呼ばれる密な編み目構造の部分が存在することが知られていましたが、その生理的意味はほぼ不明でした。本研究では、マウスの初代培養膵β細胞に蛍光ラベルしたキネシン-1 蛋白質と Hsp90 蛋白質の両者を発現させ、さらに小胞体を緑色マーカー蛋白質でラベルすることにより、これらの関係性を蛍光顕微鏡を用いたライブイメージングにより調べました。その結果、キネシン-1 蛋白質と Hsp90 蛋白質は共同して非膜オルガネラをER シート上に形成し、ダイナミックに細胞内を運動していることが明らかとなりました。
この運動は、Hsc70 シャペロンによって前半戦の折り畳みが完了した蛋白質を細胞の小胞体上でサーチし、Hsp90 とのシャペロン交換を効率よく施行して後半戦の折り畳みへと移行させるために必須なキネシン-1 分子モーターの機能であると考えられました。このように本研究を通して、これまで謎であったER シートの機能的な意義が一部解明されました。
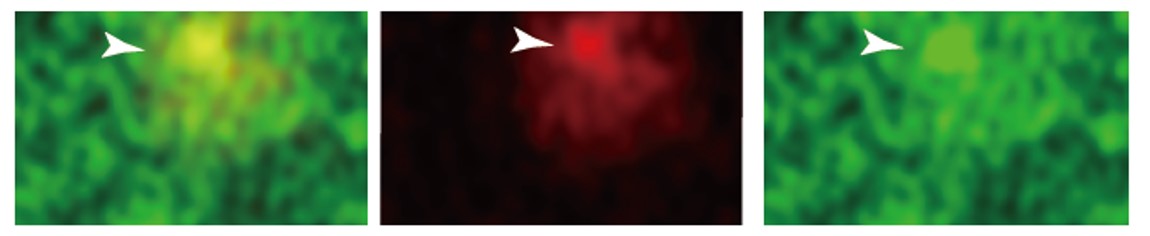
図5:ERシート(緑)とHsp90(赤)の共局在
ERシート上にHsp90蛋白質キネシン-1依存性に集積し、蛋白質の折り畳み機構を司っている(矢頭)。