JUNTENDO News&Events ニュース&イベント
2024.11.07 (THU)
- 順天堂大学について
- 研究活動
- メディアの方へ
- 企業・研究者の方へ
- 医学部
- 医学研究科
アロステリック効果を利用したI 型アレルギーを即座に抑える抗体医薬の発見 ― アナフィラキシー、花粉症、喘息など新しい治療の開発へ ―
順天堂大学大学院医学研究科血液内科学・医学部附属練馬病院 平野 隆雄 特任教授、研究基盤センター細胞機能研究室 小栁 明美 助教、免疫診断学講座 葛西 正孝 研究員、 アトピー疾患研究センター 奥村 康 センター長、アレルギー・炎症制御学 北浦次郎教授ら 及び理化学研究所 吾郷 日出夫、山本 雅貴 研究員らとの共同研究グループは、I型アレルギー*1疾患に著効する抗IgE Cε2(Fab-HMK-12)抗体*2の作製に成功しました。この抗体はマスト細胞*3上IgE受容体結合IgEを即座に剥離することによりアレルギー反応を強く阻止することが判明しました。結晶構造解析において、IgEのマスト細胞上IgE受容体結合部位(CHε3)と異なる部位(CHε2)に結合することによるアロステリック効果*4を利用した即効性抗体医薬であることがわかり、治療薬が困難なアナフィラキシー等I型アレルギー疾患の画期的な新規治療に大きく道を示しました。本研究は英科学雑誌Communications Biology電子版2024年8月23日付に掲載されました。
本研究成果のポイント
- IgE Cε2(Fab-HMK-12))抗体は、即座にIgE受容体(FcεRI)からIgEを剥離することによりアレルギー反応を抑制する。
- IgEレセプター結合部位(IgE Cε3)と異なる部位(IgEε2)を標的としたアロステリック効果を利用した即効性抗体医薬の発見
- アレルギー疾患予防薬やアレルギー発症後(アナフィラキシー等)治療薬として有効
■背景
最近の厚生労働省の疫学調査によれば国民の3-4%が喘息、30%が花粉症など、もはやアレルギー疾患は国民病と言えるでしょう。I型アレルギーは、アレルゲン物質がマスト細胞や好塩基球のIgEと反応した結果、ヒスタミンなどの化学伝達物質が放出され(脱顆粒)、血管の拡張や透過性の亢進を引き起こすことで発症します。抗IgE抗体製剤(オマリツマブ:製品名ゾレア)はIgEとIgE受容体との結合を阻害する作用から、I型アレルギー治療薬として臨床応用されています。しかし、オマリツマブは治療効果が現れるまでに時間を要すること、アナフィラキシーなど即効性に効果が必要な疾患には効果が認められないことが問題でした。そこで研究グループは、 即効的にI型アレルギー疾患の主幹をなすIgE-マスト細胞を標的とする新規予防・治療法を開発する目的で、①受身皮膚アナフィラキシー(PCA)反応*5②結晶構造解析等を利用して、既にIgE受容体に結合しているIgEに抗IgE抗体(HMK-12-Fab)が作用してアレルギー反応を抑えるかを検証致しました。
■内容
本研究では、I型アレルギー動物モデルである受身皮膚アナフィラキシー(PCA)反応を用いて、抗IgE抗体によるI型アレルギー疾患の予防・治療効果を検証しました。
ラットの皮膚にIgEを注射した後に、抗原を色素とともに静脈注射すると、皮膚局所のマスト細胞はIgEと抗原により活性化して脱顆粒します。脱顆粒により放出されるヒスタミンは血管透過性を上昇させるため、皮膚局所に色素が漏出します(図1a)。抗IgECε2抗体(Fab-MMHK-12)を投与すると、(抗原+色素)投与前(図1b)及び投与後(図1c)においてもPCA反応を阻止することが判明しました。この結果によって抗体の投与によって予防及びアレルギー発症後においてアレルギー反応を阻止するということが確認されました。(図1)
また理研共同研究グループの結晶構造解析により抗IgE抗体がマスト細胞上のIgEの受容体(FcεRI)結合部位(IgECε3)とは異なる立体構造部位であるIgECε2(ab’)2に結合することにより強い剥離が起こることが考えられました。
以上の結果からこの抗体はアロステリック部位(CHε2)を標的としたアロステリック効果によりIgEを即座に剥離しアレルギー反応を強力に阻止する抗体であることが判明致しました。(図2)
■今後の展開
アレルギー発症後治療は効果に時間を要すること、即効性効果が期待される薬剤が存在しないことが問題でした。抗IgECε2(Fab-HMK-2)抗体はマスト細胞上IgEの受容体(FcεRI)結合部位(IgE Cε3)と異なるアロステリック部位である(IgE Cε2)に結合しIgEを強力に剥離する作用によりアレルギー疾患の予防、及び発症後治療に有用なことが判明しました。現在臨床で唯一用いられている抗IgE抗体(オマリズマブ) はIgE受容体に結合するIgEに結合できないのに対して、IgE受容体結合IgEを標的としアロステリック効果を利用してIgE-IgE受容体複合体に直接作用する画期的な新規抗体医薬の開発に尽力して行きます。
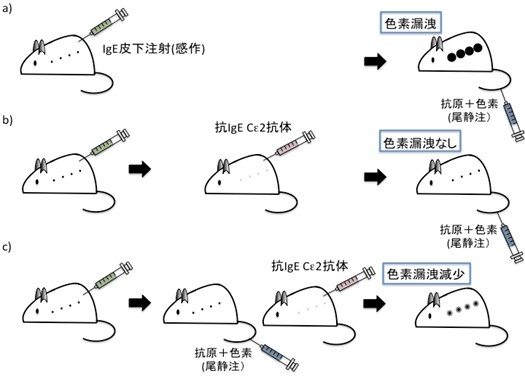
図1 抗IgECε2抗体のアレルゲン投与前後での受身皮膚アナフィラキシー(PCA)反応の抑制
(a) ラット皮膚にIgEを注射した後に、抗原を色素とともに静脈注射すると、皮膚局所のマスト細胞はIgEと抗原により活性化して脱顆粒し皮膚局所に色素が漏出する。
(b) IgEを皮膚感作しその後抗IgECε2抗体を投与し(抗原+色素)注射するとPCA反応を阻止する。
(c) IgEを皮膚感作し(抗原+色素)注射した後に抗IgECε2抗体を投与してもPCA反応を抑制する。
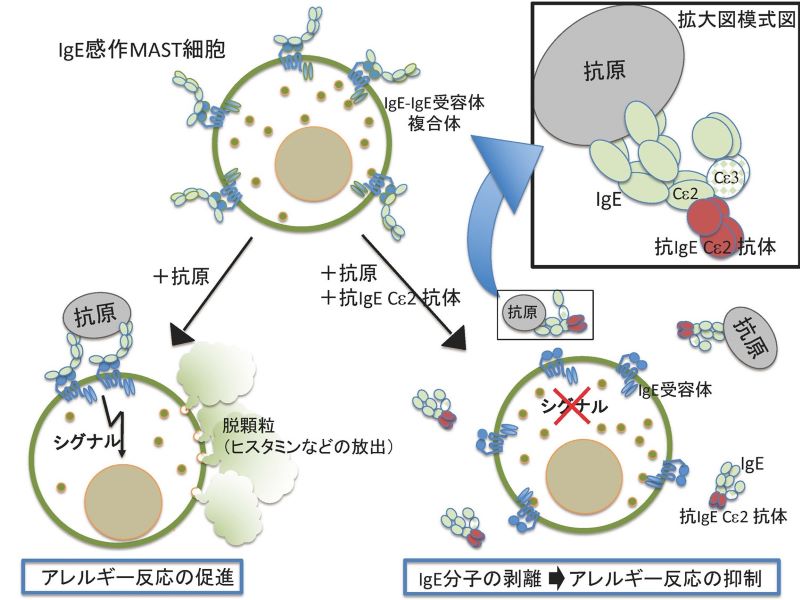
図2 本研究おけるI 型アレルギーを即座に抑制する機序
IgE受容体にIgEが結合してIgE-IgE受容体複合体が形成される。抗原がIgEに結合してIgE受容体を刺激するとマスト細胞はシグナルが入り活性化してヒスタミンなどの細胞内顆粒を放出(脱顆粒)によりアレルギー反応が起こる。(左下図:アレルギー反応の促進)抗IgECε2抗体を投与するとIgE-IgE受容体複合体から即座にIgEが剥離されるため血中に抗原・IgE・抗IgECε2複合体(右図上:拡大模式図)などが遊離し、I型アレルギー反応を強く抑制する(右下図:IgE分子の剥離→アレルギー反応の抑制)。
■用語解説
*1 I型アレルギー: IgEが関与することで引き起こされるアレルギー反応。高親和性IgE受容体に結合したIgE抗体がアレルゲン(抗原)と結合するとマスト細胞が活性化し、細胞内顆粒のヒスタミンが放出(脱顆粒)され血管や平滑筋に作用してアレルギー症状を引き起こす。即時型アレルギー反応と呼ばれる。
*2 抗IgE Cε2(Fab-HMK-12)抗体: IgE抗体はY字型の複合体の構造をしている。上部はFabといい、抗原と結合する部位である。下部はFcと呼ばれIgE受容体と結合する部位である。本研究で作製した抗IgECε2抗体はIgECε2に結合する抗体の断片であり、HMK-12と呼ばれる。
*3 マスト細胞: 肥満細胞と呼ばれる。肥満細胞は血管周囲、皮膚肺、消化管、肝臓など臓器に分布している。肥満細胞の細胞表面にIgEが結合する高親和性IgE受容体をもつ。アレルゲン(抗原)と反応するとヒスタミンなどの化学伝達物質を放出し、アレルギー反応を引き起こす。アレルギー反応の中心となる細胞である。
*4 アロステリック効果: allosteric effect_ 抗体や酵素などの機能分子が標的タンパク質の活性中心部位ではない部位(アロステリック部位)に結合することで、その機能を制御する効果。
*5 受身皮膚アナフィラキシー反応(PCA反応): ラット,マウスの皮内にIgE抗体を投与すると、皮膚のマスト細胞のIgE受容体にIgEが結合する(感作)。抗原を色素とともに静脈注射すると、皮膚局所のマスト細胞はIgEと抗原により活性化して脱顆粒し皮膚局所に色素が漏出する。この反応はI型アレルギー症状を反映し、IgE 抗体の検出に用いられPCA 反応と言われる。
研究者のコメント
現在、生命を脅かすアナフィラキシーの治療は、対症療法であるエピネフェリン注射とステロイド薬が主体でありアレルギー機構を標的とする治療薬はありません。このような抗体医薬がアナフィラキシー特効薬として将来臨床の現場で常備されることを切に期待します。
■原著論文
本研究はCommunicationsBiology誌のオンライン版に2024年8月23日付で公開されました。
タイトル: Allosteric inhibition of IgE-FcεRI interactions by simultaneous targeting of IgE F(ab’)2 epitopes
タイトル(日本語訳): IgE(ab')2エピトープを標的とする抗IgE抗体はIgE-IgE受容体相互作用をアロステリックに阻止する。
著者: Takao Hirano, Akemi Koyanagi, Hideo Ago, Masaki Yamamoto, Jiro Kitaura, Masataka Kasai & Ko Okumura
著者(日本語表記): 平野 隆雄1)、小栁 明美2)、吾郷 日出夫3)、山本 雅貴3)、北浦 次郎4,5)葛西 正孝4)、奥村 康4)
著者所属: 1) 順天堂大学医学部附属練馬病院血液内科、2) 順天堂大学大学院医学研究科研究基盤センター,細胞機能研究室、3) 理化学研究所 放射光科学研究センター生物系ビームライン基盤グル-プ生命系放射光利用システム開発チーム4)順天堂大学大学院医学研究科アトピー疾患研究センター 5)順天堂大学大学院医学研究科アレルギー・炎症制御学
DOI: https://doi.org/10.1038/s42003-024-06633-4
本研究は科学研究費:JSPS21K08447 及び理化学研究所:放射光科学研究センター生物系ビームライン基盤グループ【理研BINDS-AMED JP21am0101070】のご支援を受け共同研究の基に実施されました。なお本研究にご協力いただいた皆様には深謝いたします。