JUNTENDO News&Events ニュース&イベント
2025.08.22 (FRI)
- 順天堂大学について
- 研究活動
- メディアの方へ
- 企業・研究者の方へ
- 医学部
- 医学研究科
脳梗塞後の回復を促す新たな治療法の可能性 ー運動後の多血小板血漿が神経再生を強力にサポートー
順天堂大学大学院医学研究科神経学の宮内淑史大学院生、宮元伸和准教授、服部信孝特任教授、山梨大学大学院総合研究部医学域の上野祐司教授(順天堂大学医学部神経学講座客員教授)らの研究グループは、簡便に採取可能で再生医療でも注目される「多血小板血漿(Platelet-Rich Plasma: PRP)*1」から抽出したエクソソーム*2が、慢性期の脳梗塞後の神経回復にどのような効果を持つかを調査しました。特に、「運動を行ったラット」から採取したPRP由来エクソソーム(aPRP-EVs)と、「運動をしていないラット」からのPRP由来エクソソーム(nPRP-EVs)の比較を通じて、運動がもたらす生理的変化がエクソソームの治療効果に与える影響も明らかにしました。
本研究成果のポイント
- 運動によって得られたPRP由来エクソソーム(aPRP-EVs)は、神経細胞の生存率を大きく改善
- 脳梗塞モデルラット慢性期にaPRP-EVsを投与すると、運動・神経機能の回復が促進
- 神経保護メカニズムとしてTGF-β/SMAD経路の活性化とCaシグナル(興奮毒性)の抑制が関与
■背景
脳梗塞は、世界中で主要な死因・後遺症の原因となっており、急性期には血栓溶解療法や血栓回収療法などが行われますが、発症から時間が経過した「慢性期」に対しては、リハビリ以外に有効な治療法が限られています。慢性期の機能回復を促す治療法の確立は、患者のQOL向上のためにも喫緊の課題です。
最近の研究では、細胞間コミュニケーションを担う「エクソソームを含む細胞外小胞(Extracellular Vesicles: EVs)」という微小な細胞外小胞が注目されており、再生医療や神経疾患治療への応用が期待されています。
■内容
今日では、骨髄間葉系幹細胞由来のEVsによる脳梗塞後の再生効果に関する報告はありますが、PRP由来のEVsの効果は明らかになっていません。本研究は、慢性期の脳梗塞に対する新たな治療法として、PRP-EVs、特に運動負荷を受けたラットから得たaPRP-EVsが持つ治療効果を検証したものです。エクソソームは細胞から分泌される微小な小胞で、タンパク質やマイクロRNAなどの情報分子を含み、他の細胞との情報伝達を担うことから、再生医療や神経疾患治療への応用が注目されています。
研究ではまず、運動を行ったラット(アスリート群:トレッドミル運動15 m/分、30分/日、週3回、4週間)と、運動を行わなかったラット(非アスリート群)からPRPを採取し、それぞれからエクソソームを分離。エクソソーム内の成分を比較した結果、運動によって得られたaPRP-EVsでは、再生に関与するとされるタンパク質(CD63、TGF-β1、VEGFなど)の発現が明らかに高く、運動によってエクソソームの内容が質的に変化していることが確認されました。
次に、脳梗塞病態を模倣した神経細胞(in vitro、無酸素無糖負荷Oxygen Glucose Deprivation: OGD *3)および中大脳動脈閉塞(MCAO)モデルラット(in vivo)を用いた実験で、aPRP-EVsの治療効果を評価しました。OGD処理を行った神経細胞に対してaPRP-EVsを添加すると、細胞の生存率が有意に高まり、神経軸索の成長を示す指標(pNFH)の発現が促進されました。また、行動解析により、aPRP-EVsを7日目に静脈投与されたMCAOモデルラットは、運動機能や神経機能の回復が著しく、脳梗塞体積も縮小していることが示されました(図1)。
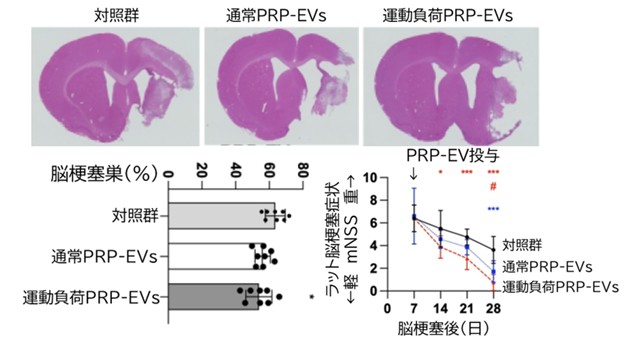
図1:脳梗塞作成後28日における脳梗塞巣・脳梗塞症状比較
脳梗塞作成7日後(脳梗塞亜急性期から慢性期)に多血小板血漿から作成したエクソソーム(PRP-EVs)もしくは、運動負荷を行ったラットから抽出したPRP-EVsを投与し、比較したところ、対照群に比し、脳梗塞は縮小しており、mNSS(げっ歯類での脳梗塞症状評価項目)は軽減しました。
さらに、網羅的解析による分子メカニズムの解析から、aPRP-EVsの効果はTGF-β/SMADシグナルの活性化と、カルシウム(Ca²⁺)シグナルの抑制を通じて発揮されていることが明らかになりました(図2)。具体的には、TGF-β1の発現増加、SMAD4の核内移行、NMDAR2B(NMDA受容体サブユニット)の発現抑制が観察されました。これは、神経再生の促進と同時に、興奮毒性による神経細胞死を防ぐ両面の作用を持つことを意味しています。
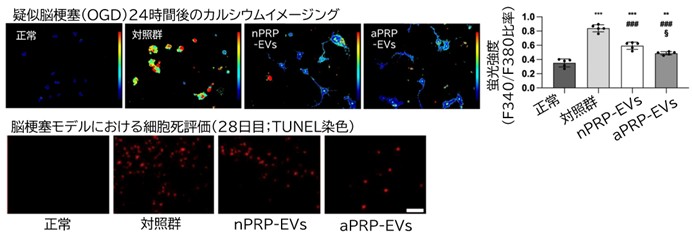
図2:上段 疑似脳梗塞(OGD)におけるカルシウムイメージング、下段 脳梗塞28日後の細胞死評価
疑似脳虚血においては対照群でカルシウムイメージングにおける蛍光強度が増加しており、その結果として動物モデルにおける細胞死が増加しました。通常nPRP-EVs、運動負荷aPRP-EVs投与することでカルシウムイメージングにおける蛍光強度が低下、細胞死が抑制されています。この効果は運動負荷aPRP-EVsで顕著でした。
さらに、TGF-β受容体阻害薬(Galunisertib)およびNMDA受容体作動薬(NMDA)との併用実験では、いずれもaPRP-EVsの神経保護作用が減弱し、TGF-β/SMADおよびカルシウムシグナルの両経路がそれぞれ独立して治療効果に寄与している可能性が示唆されました。
本研究の重要なポイントは、「運動」がPRPの治療効果を大きく高めるという点です。運動により血中の成分が変化し、それがエクソソームを通じて脳に良い影響を及ぼすという事実は、既存の幹細胞由来エクソソームと比較しても、より安価で、臨床応用が現実的なアプローチといえます(図3)。
総じて、aPRP-EVsは神経再生と神経保護の双方を兼ね備えた新しい再生医療戦略として、慢性期脳梗塞の治療に有望であると考えられます。今後は、ヒトへの応用に向けた臨床研究や、最適な投与タイミング・量、さらに高齢者や基礎疾患を有する患者への効果検証が求められます。
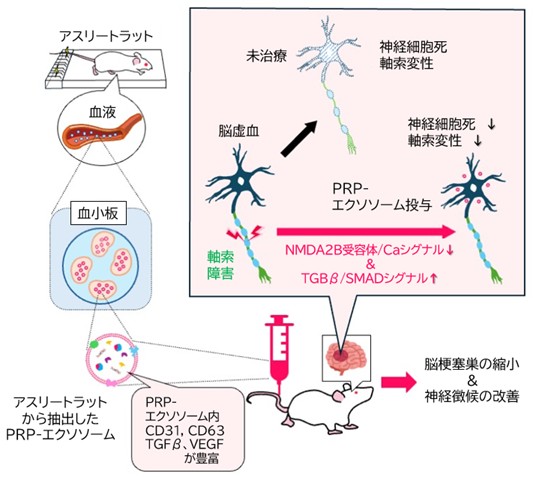
図3:本研究で明らかになったPRP由来エクソソームの脳梗塞後遺症軽減機序
運動負荷によって血小板内に含まれるエクソソームの質的変化によりNMDA2B受容体シグナル、カルシウムシグナルが低下、さらにTGFβ/SMADシグナルが上昇することで、脳虚血後の神経細胞の細胞死、軸索変性を抑制し脳梗塞巣の縮小脳梗塞後神経徴候の改善をもたらしました。
■今後の展開
本研究は、運動負荷によって得られた多血小板血漿(PRP)由来のエクソソーム(aPRP-EVs)が、慢性期脳梗塞後の神経再生や機能回復を促進することを明らかにし、PRPを用いた再生医療の新たな可能性を示しました。特に、TGF-β/SMAD経路の活性化とカルシウムシグナルの抑制という複数の経路を同時に制御することで、神経保護と軸索再生を両立できる点が大きな特徴です。さらに、PRPは採取・保存が容易であり、幹細胞由来EVsと比較して低コストかつ臨床応用性に優れている点も大きな利点です。
今後は、ヒトでの安全性・有効性の検証をはじめ、高齢者や疾患患者における再現性の評価、運動以外の方法でPRP-EVsの質を高める代替手段の開発、さらには最適な投与時期や用量の探索が求められます。本研究は、慢性期脳梗塞に対する革新的な治療法開発に向けた第一歩になると確信しています。
■用語解説
*1 多血小板血漿(Platelet-Rich Plasma: PRP):血小板を多く含んだ血漿のことです。血小板には、傷ついた組織を修復する成長因子が含まれており、PRPを患部に注射することで、組織の再生を促し、痛みを軽減する効果が期待できます。整形外科領域変形性膝関節症で臨床応用をされています。
*2 エクソソーム:細胞から分泌される直径50~150nmの顆粒状の物質で、細胞外小胞の一種です。細胞間の情報伝達や、病気との関連性が注目されています。
*3 無酸素無糖負荷(Oxygen Glucose Deprivation: OGD):脳梗塞の研究において、脳の細胞が酸素や栄養不足にさらされた状態を模倣するために用いられる実験手法です。OGD刺激は、脳梗塞で起こる細胞死や炎症反応を研究する上で重要な役割を果たします。
■原著論文
本研究はJournal of Cerebral Blood Flow & Metabolism誌のオンライン版に2025年8月20日付で公開されました。
タイトル: Exercise-induced extracellular vesicles derived from platelet-rich plasma improved recovery after ischemic stroke
タイトル(日本語訳): 運動誘発性多血小板血漿由来の細胞外小胞は、虚血性脳卒中後の回復を改善した
著者:Yoshifumi Miyauchi 1), Nobukazu Miyamoto 1), Toshiki Inaba 1), Hai-Bin Xu 1), Chikage Kijima 1), Kenichiro Hira 1), Nobutaka Hattori 1)2), Yuji Ueno 1)3)
著者(日本語表記):宮内淑史、宮元伸和、稲葉俊東、徐海濱、木島千景、平健一郎、服部信孝、上野祐司
著者所属:1)順天堂大学医学部神経学講座、2)理化学研究所脳神経化学研究センター神経変性疾患共同研究室、3)山梨大学医学部内科学講座神経内科学教室
DOI: 10.1177/0271678X251369219
本研究は、科学技術振興機構(JST) 創発的研究支援事業(課題番号:JPMJFR210K)、文部科学省私立大学戦略的研究基盤形成支援事業(課題番号:S1411066)の支援により実施されました。なお、本研究にご協力いただいたセルソース株式会社、皆様には深謝いたします。