JUNTENDO News&Events ニュース&イベント
2025.10.23 (THU)
- 順天堂大学について
- 研究活動
- メディアの方へ
- 企業・研究者の方へ
- 医学部
- 医学研究科
α-シヌクレイン凝集機構の発見と化合物によるその制御 - パーキンソン病の新しい治療戦略の提案 -
順天堂大学大学院医学研究科の武井智暉 大学院生、大学院医学研究科老人性疾患病態・治療研究センターの笹澤有紀子 准教授、大学院医学研究科オートファジー調節化合物探索研究講座の井本正哉 特任教授、大学院医学研究科神経学の服部信孝 特任教授らの研究グループは、慶應義塾大学・筑波大学・北海道大学の研究グループと共同で、α-シヌクレイン凝集体の新しい形成メカニズムを解明しました。パーキンソン病患者の脳内ではレビー小体と呼ばれる異常タンパク質の凝集体が観察されますが、これまで、その主要成分であるα-シヌクレインの凝集機構は不明でした。今回、ユビキリン2の液-液相分離がこのα-シヌクレイン凝集体形成を触媒することを明らかにし、さらにユビキリン2に結合する化合物がα-シヌクレイ凝集体形成を阻害することを見出しました。したがって、本成果はパーキンソン病の新しい治療戦略を示したものです。本論文はEMBO Journal誌のオンライン版に2025年10月14日付で公開されました。
本研究成果のポイント
- パーキンソン病の発症原因となるα-シヌクレインの凝集メカニズムの解析研究を実施
- ユビキリン2の液-液相分離がα-シヌクレイン凝集体形成を触媒することを発見
- パーキンソン病の新しい治療薬の開発へ
■背景
パーキンソン病は、振戦や筋固縮、運動緩慢といった運動症状を特徴とする代表的な神経変性疾患です。その病理学的特徴の一つが、黒質ドーパミン神経の脱落と細胞内に形成されるレビー小体の存在です。レビー小体の主要構成成分はα-シヌクレイン*1という小型タンパク質であり、その異常な凝集が病態の中心に位置づけられています。α-シヌクレインは通常は可溶性の単量体として存在しますが、ミスフォールディングを起こすとオリゴマーや線維状凝集体を形成し、細胞毒性を示すと考えられています。このため、本研究ではα-シヌクレインの凝集機構の解明と、その阻害を基盤とした治療法の開発を目指した研究を実施しました。
■内容
液–液相分離(liquid–liquid phase separation、LLPS)*2とそれに続く液–ゲル/固体への転移*3は、神経変性疾患に関連するタンパク質の共通の凝集機構と考えられています。パーキンソン病病理の主要構成成分であるα-syn(α-シヌクレイン)は、LLPSを起こし、それによって凝集形成が加速されることが報告されています。しかし、α-synのLLPS誘導には、非常に高濃度のα-syn(200 μM)と、非常に長い期間(20日)が必要であり、生理的なメカニズムとは考えにくいです。そこで、我々はα-synのLLPSを介した凝集には他の細胞内因子が関わっているのではないかと考えました。本研究では、α-syn LLPSそのものではなく、ユビキリン-2(UBQLN2)がLLPSを誘導して形成される液滴によってα-synの凝集が促進されることを示しました。すなわち、UBQLN2液滴が形成されるとそこにα-synが取り込まれ、UBQLN2とα-synが相互作用します。さらに、UBQLN2の液滴は時間と共に液–ゲル/固体転移によってゲル化しますが、その過程で液滴内のα-synが病原性フィブリル*4へと変換されることを試験管レベルと細胞レベルで確認しました。さらに、孤発性パーキンソン病患者の脳切片を免疫組織化学的に解析したところ、黒質のレビー小体にUBQLN2が存在することが明らかとなり、UBQLN2が生体内においてもα-syn凝集に関与することが示唆されました。
一方、我々は以前、UBQLN2に結合する小分子化合物SO286を見出していました。このSO286はUBQLN2のLLPSを制御すると考えられているSTI1ドメインに結合し、このことによってUBQLN2の自己会合およびα-synとの相互作用の両方を阻害し、その結果α-synの病原性フィブリル化を抑制しました。以上の知見は、UBQLN2液滴がα-synフィブリル化を触媒することを明らかにするとともに、UBQLN2のようなフィブリル化触媒タンパク質を標的とする小分子が神経変性疾患に対する新たな治療法となり得ることを示しています。
■今後の展開
今回、研究グループはパーキンソン病の原因と考えられているα-シヌクレインの凝集/フィブリル化メカニズムを解明し、従来はたんぱく質の品質管理に関わると考えられていたUBQLN2に、たんぱく質凝集を触媒するというこれまで知られていなかった役割があることを見出しました。また、パーキンソン病以外の神経変性疾患であるアルツハイマー病の原因たんぱく質タウや、筋萎縮性側索硬化症や前頭側頭型認知症のTDP-43やFUSがLLPSによって凝集することが報告されていますが、我々の研究グループの予備的な試験では、タウがα-シヌクレイン同様にUBQLN2のLLPSによって凝集が触媒されていて、その凝集がSO286によって抑制されることを見出しています。このことからUBQLN2のLLPSを介したたんぱく質凝集メカニズムは神経変性疾患原因たんぱく質の共通した凝集メカニズムの可能性があると考えられます。研究グループはSO286をはじめ、いくつかのUBQLN2に結合する薬剤を開発し、非臨床及び臨床試験を精力的に実施することで、パーキンソン病だけでなく多くの神経変性疾患で苦しんでいる患者の治療に貢献できると考えています。
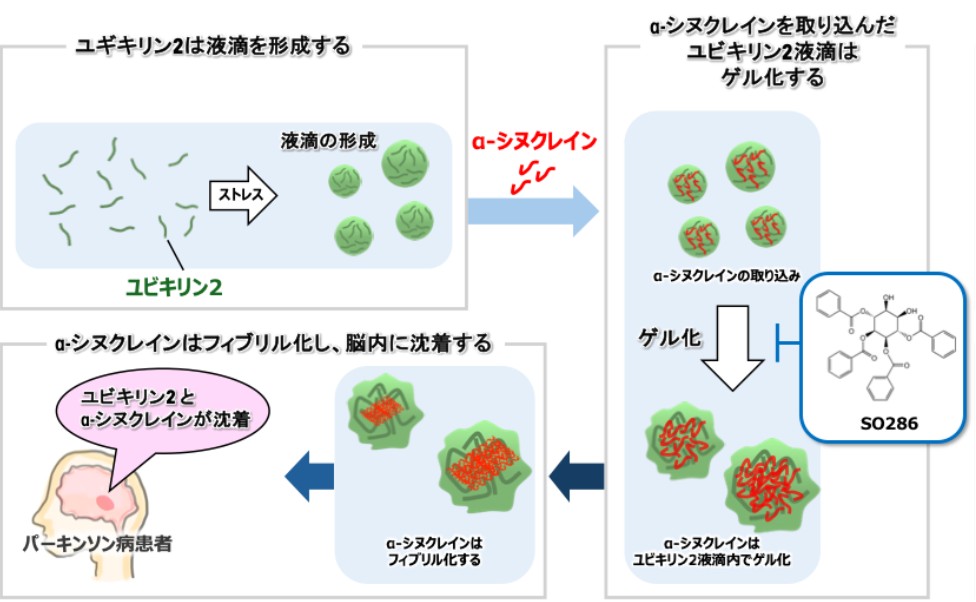
図1:本研究で明らかになったa-シヌクレインの線維化メカニズム
α-シヌクレインはユビキリン2の液滴に取り込まれる。ユビキリン2液滴に取り込まれたα-シヌクレインは時間経過と共にゲル化し、線維化し脳内に沈着する。SO286はα-シヌクレインを取り込んだユビキリン2液滴のゲル化を抑制することでa-シヌクレインの線維化を抑制したことから、パーキンソン病の治療薬への応用が期待される。
■用語解説
*1 α-シヌクレイン: 140個のアミノ酸からなる疎水性に富む可溶性タンパク質で、神経細胞に多く存在し、膜結合や自己凝集しやすい性質をもつ。
*2 液–液相分離(liquid–liquid phase separation、LLPS): たんぱく質分子同士の相互作用で溶液中に液状の濃縮相が生じる現象。
*3 液–ゲル/固体への転移: LLPSで形成された液滴が時間とともにゲルまたは固体状へ変化する現象。
*4 病原性フィブリル: タンパク質が異常凝集した、細胞に障害を与えるような線維状構造。
■原著論文
本研究はEMBO Journal誌のオンライン版に2025年10月14日付で公開されました。
タイトル: Ubiquilin-2 liquid droplets catalyze α-synuclein fibril formation
タイトル(日本語訳): ユビキリン2の液滴はα-シヌクレインのフィブリル化を触媒する
著者: Tomoki Takei1,2, Yukiko Sasazawa1,2,3,4, Daisuke Noshiro5, Mitsuhiro Kitagawa1,2, Tetsushi Kataura2,6, Hiroko Hirawake-Mogi1, Emi Kawauchi2, Yuya Nakano2, Etsu Tashiro2, Tsuyoshi Saitoh7, Shigeru Nishiyama7, Seiichiro Ogawa2, Soichiro Kakuta8, Saiko Kazuno8, Yoshiki Miura8, Daisuke Taniguchi1, Viktor I Korolchuk9, Nobuo N. Noda5, Shinji Saiki1,4,6, Masaya Imoto2,4, Nobutaka Hattori1,4,10
著者(日本語表記): 武井智暉1,2, 笹澤有紀子1,2,3,4, 能代大輔5, 北川光洋1,2, 片浦哲志2,6, 茂木浩子1, 河内恵美2, 中野佑哉2, 田代悦2, 斉藤毅7, 西山繁7, 小川誠一郎2, 角田宗一郎8, 數野彩子8, 三浦芳樹8, 谷口大祐1, Viktor I Korolchuk9, 野田展生5, 斉木臣二1,4,6, 井本正哉2,4, 服部信孝1,4,10
著者所属: 1)順天堂大学医学部神経学講座、2)慶應義塾大学理工学部生命情報学科、3) 順天堂大学院医学研究科老人性疾患病態・治療研究センター、4)順天堂大学大学院医学研究科オートファジー調節化合物探索研究講座、5) 北海道大学遺伝子病制御研究所、6) 筑波大学医学医療系神経内科学分野、7) 慶應義塾大学理工学部化学科、8)順天堂大学大学院医学研究科研究基盤センター・生体分子研究室、9)ニューキャッスル大学、10)理化学研究所脳神経科学研究センター神経変性疾患連携研究チーム
DOI: 10.1038/s44318-025-00591-1
本研究はMEXT科研費 (Grant No. 18H02099, 21H02072, 24K10651, 23K20044, 21H04820 and 24H00068), JSPS KAKENHI JP22H04922, AMED JP 16nk0101346, JP25wm0625503の支援を受け多施設との共同研究の基に実施されました。
なお、本研究にご協力いただいた皆様には深謝いたします。