JUNTENDO News&Events ニュース&イベント
2025.10.25 (SAT)
- 順天堂大学について
- 研究活動
- メディアの方へ
- 企業・研究者の方へ
- 医学部
- 医学研究科
細胞の“運び屋”に新たなルール ――脳の働きや病気の理解につながるタンパク質輸送の仕組み――
■発表のポイント
◆ 細胞の中で分子を運ぶモータータンパク質に、新しいフック状の“部品”を発見しました。
◆ この“部品”が荷物を正しくつかみ、確実に運ぶ仕組みを支えていることがわかりました。
◆ 今回の成果は、神経発達障害や繊毛病など輸送異常が関わる病気の理解や治療法開発につながると期待されます。

細胞の“運び屋” キネシン‐2が荷物を見分けて運ぶしくみ
■概要
順天堂大学大学院医学研究科特任教授/東京大学名誉教授廣川信隆博士、東京大学大学院医学系研究科教授吉川雅英博士、同東京大学特別研究員蒋緒光博士、群馬大学大学院医学系研究科助教一ノ瀬聡太郎博士らによる研究グループは、細胞の“運び屋”として働くモータータンパク質キネシン‐2(注1)が、どのように荷物を認識して運ぶのか、その仕組みを世界で初めて明らかにしました。
研究グループは、クライオ電子顕微鏡(注2)やライブセルイメージングなどの最先端技術を組み合わせることで、キネシン‐2の尾部に存在する新しいフック状の“部品”(HACドメイン)を発見し、その立体構造を原子レベルで解明しました。この部品はアダプターや荷物との結合の足場として働き、正確な輸送を可能にしていることがわかりました。
今回の成果は、モータータンパク質全体に共通する基本原理の理解につながるとともに、神経発達障害や繊毛病など細胞内輸送の不具合が関わる病気の分子基盤解明や治療法開発に役立つことが期待されます。
■発表内容
モータータンパク質は、アダプタータンパク質を介して特定の荷物(カーゴ)を認識し、ATPのエネルギーを利用して微小管(注3)のレール上を移動しながら輸送することで、細胞内の多様な機能を実現しています。しかし、カーゴ認識の分子基盤はこれまで十分に解明されていませんでした。本研究では、キネシン‐2の尾部に存在する新規構造モチーフ「HACドメイン(Hook-like Adaptor and Cargo-binding domain)」が、アダプターKAP3およびカーゴAPC(注4)との結合の足場として機能していることを世界で初めて明らかにしました。
クライオ電子顕微鏡による構造解析と質量分析・生化学的実験の結果、HACドメイン内のヘリックス‐βヘアピン‐ヘリックス構造(H-βh-Hモチーフ、(注5))がKAP3との主要な結合界面を形成していることが明らかになりました。この結合は、疎水性ポケットや静電相互作用、水素結合ネットワークを介してKIF3A/B/KAP3複合体を安定化させていました。さらにこの安定化作用に関して、KIF3AはAPCとの直接的な結合に重要な役割を果たす一方、KIF3BはKIF3A/KAP3複合体の安定化に寄与することが明らかになり、キネシン‐2分子内での機能分担が存在することが示されました。加えて、神経細胞(ニューロン)を用いたライブイメージング実験・生化学的解析により、この領域がキネシン‐2の輸送機能に不可欠であることが実証されました(図1)。
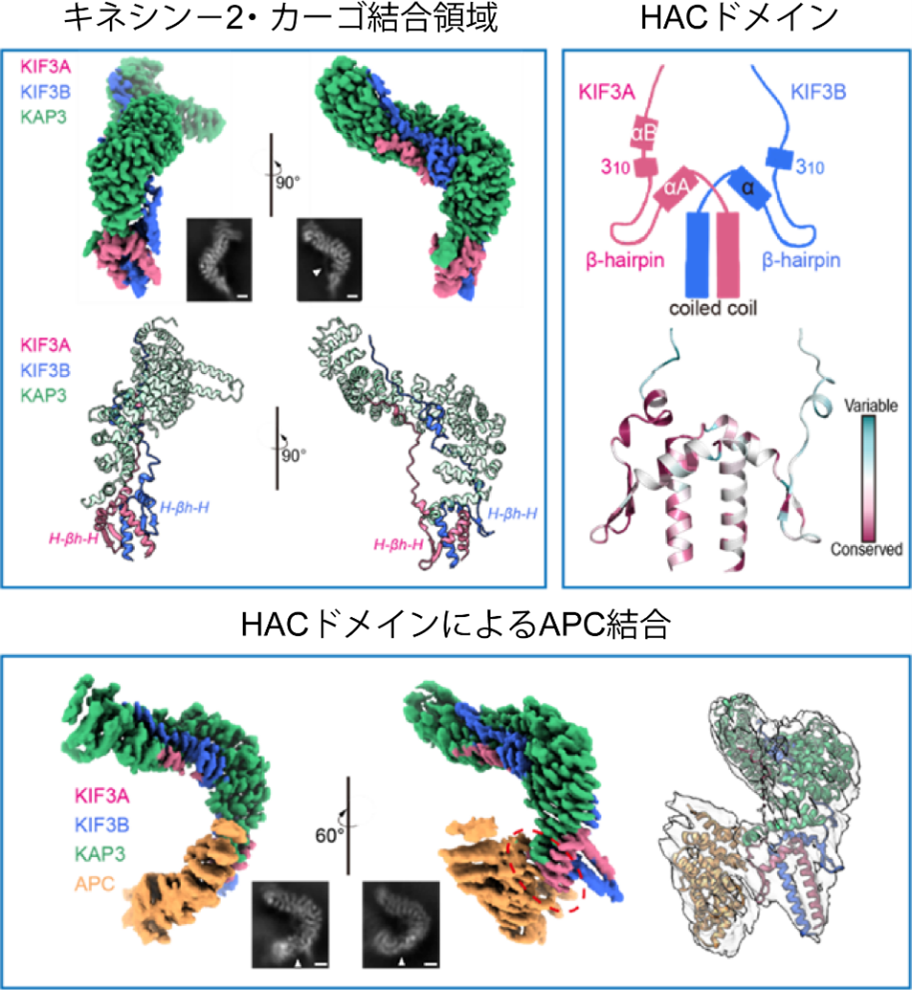
図1:KIF3のHACドメインによる特異的なカーゴ結合
(左上パネル) KIF3A/B/KAP3尾部複合体のクライオ電子顕微鏡マップと構造。挿入図には代表的な2D平均像を示し、白矢印はKIF3Aリンキングループを指しています。複合体はKIF3コイルドコイルの軸部、H-βh-H(HAC)モチーフ、伸長したテイルループ、KAP3から構成されています。
(右上パネル) HACドメインの保存性解析。
(下パネル) KIF3A/B/KAP3–APC複合体のクライオ電子顕微鏡マップとモデル。挿入図は代表的な2D平均像を示し、マップ上の赤破線円はKIF3/KAP3とAPCの結合界面を示しています。2D像のスケールバー:2 nm。
興味深いことに、この「フック状」のHAC構造は、キネシン‐1やダイニンなど他のモータータンパク質に見られる結合様式と類似しており、モータータンパク質全体に共通するカーゴ認識原理の存在を示唆しています。特に、ダイニンのFTS–HOOK–FHIP1B複合体(注6)やキネシン‐1の結合領域との比較により、アダプターとカーゴを結びつける共通の「足場」としての構造が存在することが浮かび上がりました。これにより、キネシンとダイニンに共通する統一的なカーゴ認識モデルの構築につながると期待されます。
以上の成果は、キネシン‐2に特有の輸送機構の理解を深めるとともに、神経発達障害や繊毛病などの分子基盤の解明に寄与することが期待されます。今後は、未解析領域のさらなる構造解明やリン酸化による制御機構の解明を進めることで、細胞内輸送研究の新たな展開につながると考えられます(図2,3)。
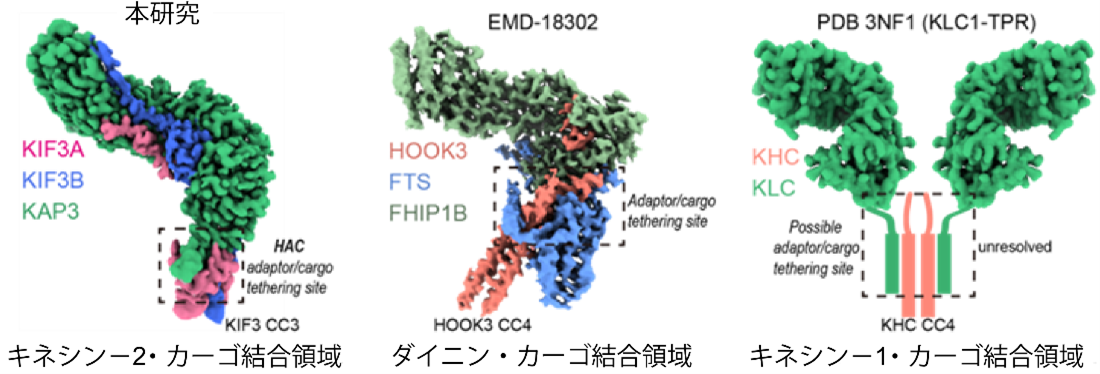
図2:フックのようなカーゴ結合構造は、キネシンとダイニンに共通するメカニズムを示唆する
本研究で得られたキネシン‐2・KIF3A/B/KAP3マップと、ダイニンのFTS–HOOK–FHIP1B (FTF) カーゴ結合アダプター複合体マップ、およびキネシン-1 KHC/KLC予測モデルとの比較。FTFのマップは(EMDB: EMD-18302)から得られており、KLC1 TPRドメインのマップは、その結晶構造(PDB: 3NF1)に基づいて生成されています。
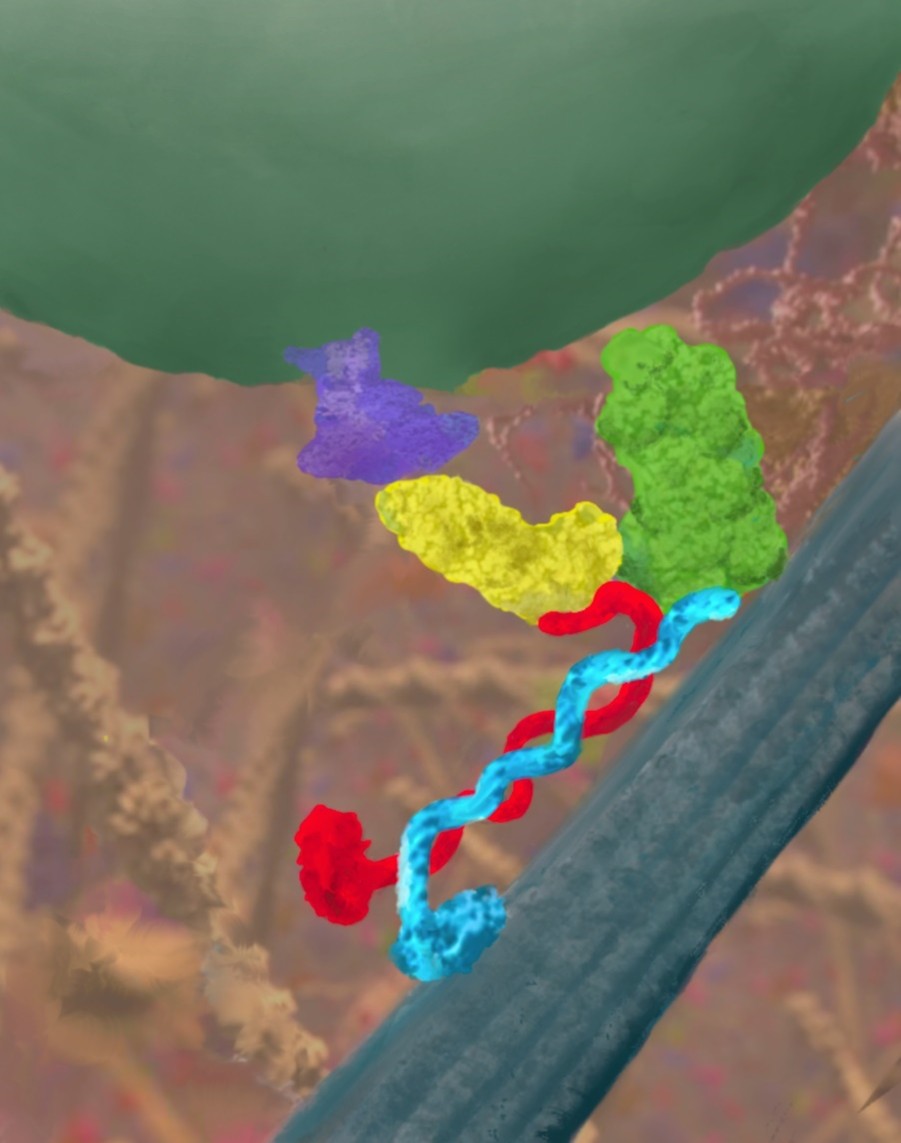
図3:キネシンによるカーゴ輸送の模式図
本図は、細胞内の「輸送ハイウェイ」を舞台に、KIF3A(赤)とKIF3B(青)からなるヘテロ二量体モーターが小胞を運ぶ瞬間を描いたものです。KIF3Aの尾部に位置するフック状(HAC)ドメインは、アダプタータンパク質KAP3(緑)を介してAPC(黄)および膜貫通型カーゴタンパク質(紫)と結合し、モーターと貨物をつなぐ橋渡し役を果たします。本研究では、このHACドメインがアダプターとカーゴの両者を認識し結合する「二重の鍵」として機能することを明らかにし、キネシン-2複合体による貨物認識の新たな原理を提示しました。
〇関連情報:
吉川研究室ホームページ https://structure.m.u-tokyo.ac.jp/
廣川研究室ホームページ http://cb.m.u-tokyo.ac.jp
■発表者・研究者等情報
東京大学大学院医学系研究科
蒋 緒光 東京大学特別研究員/日本学術振興会外国人特別研究員
吉川 雅英 教授
廣川 信隆 東京大学名誉教授(順天堂大学大学院医学研究科 特任教授)
順天堂大学大学院医学研究科
廣川 信隆 特任教授(東京大学と兼務)
群馬大学大学院医学系研究科
一ノ瀬 聡太郎 助教
■論文情報
雑誌名:Science Advances
題 名:The Hook-like Adaptor and Cargo-binding (HAC) Domain in the Kinesin-2 Tail Enables Adaptor Assembly and Cargo Recognition
著者名:X. Jiang, R. Danev, S. Ichinose, B. Niu, S. Ohtsuki, H. Yanagisawa, S. Nagatoishi, K. Tsumoto, N. Hirokawa*, and M. Kikkawa*(*責任著者)
URL: https://doi.org/10.1126/sciadv.ady5861
■研究助成
本研究は、戦略的創造研究推進事業 総括実施型研究(ERATO)「吉川(課題番号:JPMJER2202)」と科研費「吉川(課題番号:JP21H05247)」、「吉川(課題番号:JP24KF0141)」、「廣川(課題番号:JP25K09633)」、「廣川(課題番号:JP16H06372)」、「一ノ瀬(課題番号:JP24K09994)」、「蒋(課題番号:JP24K18106)」及び日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業創薬等先端技術支援基盤プラットフォーム(BINDS)(課題番号:JP23ama121002、 JP23ama121018、JP25ama121033)の支援により実施されました。
■用語解説
(注1)キネシン‐2
キネシン‐2は、ATPのエネルギーを使って微小管のプラス端方向へ移動するモータータンパク質です。細胞内輸送や鞭毛・繊毛形成に必須です。多くはKIF3A/B/CとアダプターKAP3からなるヘテロ三量体として機能し、この機能異常が統合失調症などの神経発達障害や内臓逆位を含むカルタゲナー症候群等の繊毛病を引き起こすことがわかっています。
(注2)クライオ電子顕微鏡
クライオ電子顕微鏡は、生体試料を急速に凍結し、液体窒素などの低温で維持しながら透過型電子顕微鏡で観察する技術です。結晶化が困難なタンパク質などの高分子の立体構造を、生体内に近い状態で高分解能に解析できます。そのため、創薬や生命科学の研究で広く利用されています。
(注3)微小管
微小管は、チューブリンからなる管状の細胞骨格で、細胞内輸送や形態維持、分裂などに必須です。プラス端とマイナス端を持ち、動的に伸縮しながら細胞内の構造を支えます。キネシンやダイニンは微小管をレールとして利用し、特定方向への分子輸送を行います。
(注4)APC
APC(Adenomatous Polyposis Coli)は腫瘍抑制因子として知られるタンパク質で、微小管のプラス端に結合します。細胞内輸送においてはキネシン‐2の代表的なカーゴの一つであり、細胞増殖制御に加えて、神経回路形成やシナプス安定化にも重要な役割を果たします。
(注5)ヘリックス‐βヘアピン‐ヘリックス構造(H-βh-H)
ヘリックス‐βヘアピン‐ヘリックス構造は、βヘアピンの水素結合によって骨格が固定され剛性が保たれる一方、ヘリックスの相対角度にある程度の自由度が残るため、局所的に柔軟です。この半固定構造により、結合相手に合わせて相互作用面を最適化できるのが特徴です。
(注6)ダイニンのFTS–HOOK–FHIP1B複合体
ダイニンは微小管上をマイナス端方向に移動するモータータンパク質で、FTS–HOOK–FHIP1B複合体をアダプタータンパク質として用い、カーゴに結合します。