JUNTENDO News&Events ニュース&イベント
2026.01.07 (WED)
- 順天堂大学について
- 研究活動
- メディアの方へ
- 企業・研究者の方へ
- 医学部
- 医学研究科
生体内で高濃度に維持される可溶型ST2が食物アレルギーを抑制 ―食物アレルギーの予防・治療法開発へ―
順天堂大学大学院医学研究科アトピー疾患研究センターの伊沢久未 特任准教授、北浦次郎 教授、奥村康センター長ら、および小児科学講座 小嶋まゆき非常勤助手、小児思春期発達・病態学の東海林宏道 教授、清水俊明 特任教授、広島大学の中江進 教授らの共同研究グループは、可溶型ST2*1だけを欠損する遺伝子改変マウスの作出に成功し、生体内で高濃度に維持される可溶型ST2が食物アレルギーを抑えていることを明らかにしました。可溶型ST2はIL-33シグナルを阻害し、小腸マスト細胞の増加および活性化亢進を抑制して食物アレルギー*2を抑えることを証明しました。また、皮膚や小腸などの線維芽細胞*3が可溶型ST2の主要な産生細胞として重要であることを見出しました。本成果は、食物アレルギーの抑制メカニズムの解明から予防・治療法開発への道を開くものです。
本研究成果は、米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America)誌のオンライン版に2026年1月5日付で掲載されました。
本研究成果のポイント
- 生体内で高濃度に維持される可溶型ST2がIL-33シグナルを阻害して食物アレルギーを抑えていることをマウスモデルで証明。
- 線維芽細胞は可溶型ST2の主要な産生細胞として食物アレルギーの抑制に寄与する。
- 食物アレルギーを抑える生体内の仕組みの解明が予防・治療法開発への道を開く。
■背景
生体バリアとなる上皮細胞などの障害に伴い放出されるIL-33などのサイトカインは2型炎症*4を誘導します。そこで産生される2型サイトカイン(IL-4やIL-13など)はアレルギー疾患の基盤を作ります。食物アレルギーではIL-33はIL-4と協調して小腸のマスト細胞を増加させます。また、IL-33は抗原と特異的IgEによるマスト細胞の活性化を亢進させます。ST2はIL-33の受容体であり、ST2遺伝子から膜型ST2(ST2L)と可溶型ST2(sST2)が作られます。細胞表面のST2LはIL-33を捉えてシグナルを伝えます。一方、sST2はIL-33を捕捉して細胞のIL-33シグナルを阻害すると考えられていました。しかし、生体内におけるsST2の真の役割は不明でした。本研究では、さまざまな疾患における内因性sST2の役割を明確にするため、ST2Lを正常に発現するけれどもsST2だけを欠損する遺伝子改変マウスを作出しました。さらに、食物アレルギーにおける内因性sST2の役割を解明するため、野生型とsST2欠損マウスの食物アレルギーモデルを比較解析しました。
■内容
ST2Lの転写はエクソン8からエクソン9にとび、エクソン11の途中でストップしますが、sST2の転写は同じエクソン8から次のイントロンの途中でストップします。そこで、遺伝子改変技術を利用してエクソン8と9の間のイントロンを除去したしたところ、正常にST2Lを発現するけれどもsST2だけを欠損するsST2欠損マウスの作出に成功しました。実際、sST2欠損マウスの血清中には、定常状態の野生型マウスで高濃度に検出されるsST2が存在しませんでした。また、sST2欠損は骨髄由来マスト細胞(BMMC)のST2L発現量に影響しませんでした。BMMCはIgEと抗原により活性化して脱顆粒し、IL-33の添加はこの脱顆粒を増強します。しかし、sST2欠損は(IL-33による)BMMCの脱顆粒亢進に影響しませんでした。また、骨髄細胞にIL-4とIL-33などを添加するとIL-9産生粘膜型マスト細胞(MMC9*5)様細胞が誘導されます。しかし、sST2欠損は(IL-33による)MMC9様細胞誘導にも影響しませんでした。従って、BMMCやMMC9様細胞の産生するsST2タンパク量はIL-33シグナルを抑制するには不十分であることが示唆されました。一方、マウスの皮膚線維芽細胞は恒常的に大量のsST2を産生することがわかり、そのタンパク量はBMMCやMMC9様細胞と比較して10倍以上でした。従って、sST2欠損は線維芽細胞をIL-33で刺激したときのサイトカイン産生量を増加させました。つまり、線維芽細胞が産生する大量のsST2はIL-33シグナルを抑制することがわかりました。興味深いことに、BMMCの含有・放出するプロテアーゼはsST2を容易に分解することがわかり、BMMCの産生・放出するタンパク量がRNA量に比して少ない原因になっていると考えられました。
次に、野生型およびsST2欠損マウスの食物アレルギーモデルを誘導しました。食物抗原の卵白アルブミン(OVA)を腹腔に投与しOVA特異的IgEを産生させたのち、OVAを経胃管投与(OVAチャレンジ)して食物アレルギーを誘導しました。OVAチャレンジ前の血清中のOVA特異的IgE値は両者で同等でしたが、OVAチャレンジにより誘導される食物アレルギーの症状(下痢)はsST2欠損マウスで早期から高頻度に認められました。つまり、内因性のsST2を欠損すると食物アレルギーが悪化することがわかりました。また、sST2欠損マウスの小腸ではMMC9および成熟したマスト細胞が多く、個々のマウス細胞の脱顆粒率も亢進していることがわかりました。さらに、sST2欠損マウスの小腸ではIL-4やIL-13などの2型サイトカインやIL-33などの発現量が増加していました。他方、sST2を模倣するST2-Fc(ST2Lの細胞外領域とIgG1のFcを融合したタンパク)を作製し、sST2欠損マウスにST2-Fcを前投与すると、小腸のマスト細胞の数と脱顆粒率は低下し、食物アレルギー症状は抑えられました。従って、生体内で高濃度に維持されるsST2はIL-33シグナルを阻害し、小腸マスト細胞の増加と脱顆粒亢進を抑制することによって、食物アレルギーを抑えることが示されました。
また、野生型とsST2欠損マウスの骨髄キメラマウス*6を作製して解析したところ、定常状態における血清中sST2の維持および食物アレルギーの抑制において血球系細胞と非血球系細胞はほぼ同定度の役割を担うことがわかりました。後者の中では線維芽細胞が主要なsST2産生細胞であることがわかりました。食物アレルギーでは血清中sST2は約1.5倍上昇しますが、その多くは線維芽細胞由来である可能性が示唆されました。食物アレルギーでは皮膚や小腸などでIL-4やIL-13が上昇し、これらが線維芽細胞を刺激してsST2産生を誘導すると考えられました。
以上の結果から、内因性sST2が食物アレルギーを抑制するメカニズムが明らかになりました(図1)。
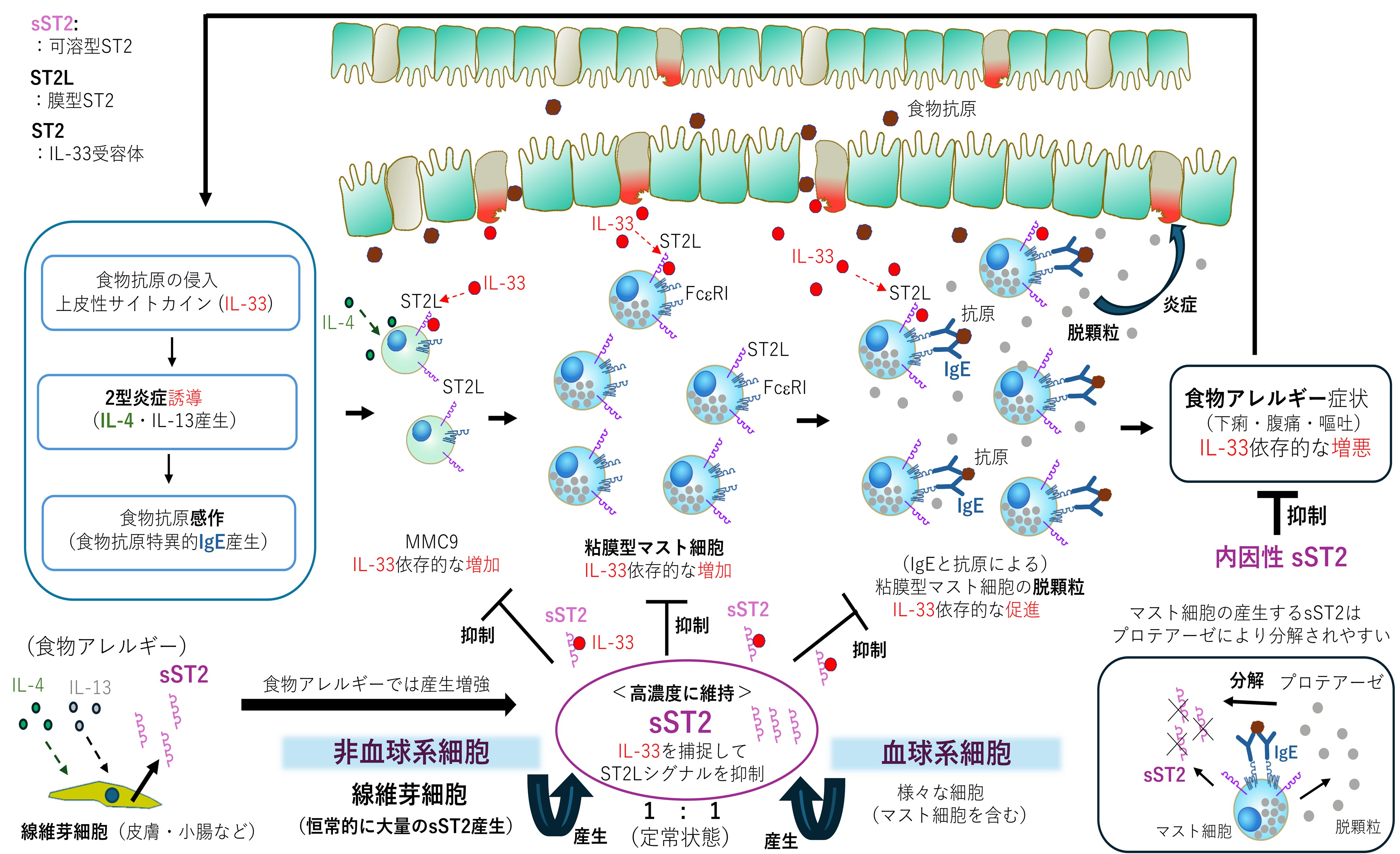
図1:可溶型ST2が食物アレルギーを抑制するメカズム
食物抗原が体内に侵入するときにバリア破壊を伴うと、上皮性サイトカインの働きにより2型炎症が誘導されます。2型サイトカイン(IL-4、IL-13など)は抗原特異的IgEの産生を促します。小腸では、IL-33がIL-4と協調してMMC9を増やし、その結果、成熟した小腸マスト細胞が増加します。抗原特異的IgEは小腸マスト細胞の高親和性IgE受容体(FceRI)に結合しますが、食物抗原がその特異的IgEに結合すると小腸マスト細胞は活性化し、細胞内の顆粒を放出します。IL-33はIgEと抗原によるマスト細胞の脱顆粒を強める作用もあります。顆粒に含まれる分子が腸管に作用して下痢・腹痛・嘔吐などの食物アレルギー症状を引き起こすので、小腸マスト細胞の数が多く、個々の脱顆粒率が高いと、食物アレルギーは悪化すると考えられます。生体内で高濃度に維持されるsST2はIL-33を捕捉してIL-33の作用を阻害し、小腸マスト細胞の増加と脱顆粒亢進を抑えます。このメカニズムによって、内因性sST2は食物アレルギーを抑制します。また、定常状態では血球系細胞と非血球系細胞がsST2の産生に関して同程度の役割を担い、後者では線維芽細胞が恒常的に大量のsST2を産生します。食物アレルギーで産生されるIL-4やIL-13は小腸や皮膚の線維芽細胞を刺激してsST2産生を増加させます。他方、マスト細胞が産生するsST2のRNA量は高いけれども、sST2タンパクはマスト細胞プロテアーゼにより分解されやすく、sST2産生細胞としてのマスト細胞の役割は相対的に小さいこともわかりました。
■今後の展開
研究グループは、高濃度に維持される内因性sST2が食物アレルギーを抑えていることを明らかにしました。sST2の産生細胞として血球系細胞と非血球系細胞がほぼ同等の役割を担うこと、後者では線維芽細胞が主要な産生源であることがわかりました。今後、食物アレルギーの予防・治療法として、生体内のsST2だけを増加させる薬剤やIL-33シグナルを阻害する分子生物学的試薬の開発などが期待されます。また、IL-33シグナルは感染、腫瘍、心血管疾患、代謝疾患など多くの病態に関与しますが、それらの病態における内因性sST2の役割は不明のままです。これらの問題を解決するため、本研究で作出したsST2欠損マウスは極めて有用であると考えられます。
■用語解説
*1 ST2: サイトカインであるIL-33の受容体。ST2遺伝子から膜型ST2(ST2L)と可溶型ST2(sST2)が作られる。IL-33はさまざまな細胞内に存在し、細胞の障害などにより放出されて作用を発揮する。
*2 食物アレルギー: 食物抗原に対する特異的IgEが産生された後、食物抗原とIgEが小腸のマスト細胞を活性化して細胞内の顆粒(ヒスタミンなどを含む)を放出させて、消化管症状を引き起こすアレルギー。
*3 線維芽細胞 : 皮膚などの結合組織を構成する細胞の一つ。
*4 2型炎症: アレルギー疾患の中心的な病態。産生される2型サイトカイン(IL-4やIL-13など)が誘導する炎症。
*5 IL-9産生粘膜型マスト細胞(MMC9): 小腸では前駆細胞からIL-4やIL-33の刺激により分化・誘導される。MMC9が増えると小腸の成熟したマスト細胞が増加する。
*6 骨髄キメラマウス: マウスに放射線照射をして血球系細胞を破壊した後、他のマウスの骨髄細胞を移植することにより作製される。
研究者のコメント
今回、体内に存在する可溶型分子に着目し、新規の遺伝子改変マウスの作出・解析から食物アレルギーの抑制メカニズムを明らかにすることができました。今後も、食物アレルギーの予防・治療法開発への期待に応えるため、地道な基礎研究を続けていきたいと考えています。
■原著論文
本研究はProceedings of the National Academy of Sciences of the United States of America誌のオンライン版に2026年1月5日付で公開されました。
タイトル: Constitutively high levels of endogenous soluble ST2 inhibit food allergic responses in mice.
タイトル(日本語訳): 恒常的に高濃度で維持される内因性の可溶型ST2は食物アレルギーを抑制する。
著者: Mayuki Kojima1,2), Kumi Izawa1), Tomoaki Ando1), Keiko Maeda1,3), Ayako Kaitani1), Nobuhiro Nakano1), Risa Yamamoto1), Shunichi Miyazaki1), Mayu Shinagawa1), Mio Sasaki1), Anna Kamei1,4), Akie Maehara1), Naoko Negishi1), Hiromichi Yamada1,2), Shino Uchida1,5), Eisuke Inage2), Yoshikazu Ohtsuka2), Susumu Nakae6), Hideoki Ogawa1), Ko Okumura1), Hiromichi Shoji2), Toshiaki Shimizu1,2), Jiro Kitaura1,4)
著者(日本語表記): 小嶋まゆき1,2)、伊沢久未1)、安藤智暁1)、前田啓子1,3)、貝谷綾子1)、中野信浩1)、山本里彩1)、宮﨑隼一1)、品川まゆ1)、佐々木深音1)、亀井杏菜1,4)、前原明絵1)、根岸尚子1)、山田啓迪1,2)、内田志野1,5)、稲毛英介2)、大塚宜一2)、中江進6)、小川秀興1)、奥村康1)、東海林宏道1)、清水俊明1,2)、北浦次郎1,4)
著者所属: 1)順天堂大学 大学院医学研究科アトピー疾患研究センター、2)順天堂大学 大学院医学研究科小児思春期発達・病態学、3)順天堂大学 医学部免疫学講座、4)順天堂大学 大学院医学研究科アレルギー・炎症制御学、5)順天堂大学 医学部消化器内科学講座、6)広島大学 大学院統合生命科学研究科
本研究はJSPS科研費JP20H03721,JP23H02946,JP22K11887、公益財団法人ニッポンハム食の未来財団などの支援を受け多施設との共同研究の基に実施されました。
なお、本研究にご協力いただいた皆様には深謝いたします。