発表論文の解説
新たなオートファジー経路を発見―革新的技術が明らかにした細胞の恒常性を維持する仕組み―
Integrated proteomics identifies p62-dependent selective autophagy of the supramolecular vault complex
Kurusu R#, Fujimoto Y#, Morishita H#, *, Noshiro D, Takada S, Yamano K, Tanaka H, Arai R, Kageyama S, Funakoshi T, Komatsu-Hirota S, Taka H, Kazuno S, Miura Y, Koike M, Wakai T, Waguri S, Noda NN, Komatsu M*. (#co-first authors, *co-corresponding authors)
Dev Cell. 2023 May 9:S1534-5807(23)00191-0. doi: 10.1016/j.devcel.2023.04.015. Online ahead of print.
順天堂大学大学院医学研究科器官・細胞生理学の小松雅明 教授、森下英晃 准教授らの研究グループは、細胞の恒常性(正常な働き)を維持する仕組みとして、新たなオートファジー経路を発見しました。研究グループは、細胞内の大規模な分解システムとして知られるオートファジーによって分解されるたんぱく質を効率よく精製し同定する革新的手法を開発しました。その結果、細胞内の巨大なたんぱく質複合体「ヴォルト」が新たなオートファジー経路により分解されること、ヴォルトの分解不全は肝細胞がんと関連することを見出しました。本研究成果はがんや神経変性疾患などのオートファジー関連疾患の発症機序の解明につながることが期待されます。
本研究成果のポイント
・オートファジーで分解されるたんぱく質を効率よく精製し同定する革新的手法を確立
・巨大なたんぱく質複合体「ヴォルト」を分解する新規オートファジー経路(ヴォルトファジー)を発見
・がんや神経変性疾患などオートファジー関連疾患の発症機序の解明につながる
背景
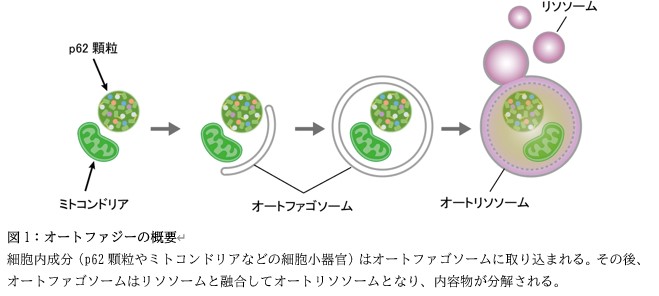
オートファジー(自食作用:細胞が自己成分を分解する機能)は、細胞内のたんぱく質や細胞小器官などをリソソームに輸送し、それらを分解する仕組みです(図1)。近年、オートファジーは細胞内を無作為に分解するだけでなく、細胞内の特定のたんぱく質を効率良く分解する作用を有することが明らかになり、この作用は「選択的オートファジー」と呼ばれています。選択的オートファジーの代表的な標的として知られているのが「p62顆粒」です。p62顆粒は、p62と呼ばれるたんぱく質とユビキチン化タンパク質などの他の様々なたんぱく質が液―液相分離して形成された、膜に包まれていない細胞小器官であり、p62顆粒の分解不全はがんや神経変性疾患の病態に関与すると考えられています。しかし、これまでp62顆粒に含まれるたんぱく質を同定する手法が存在しなかったため、p62顆粒の構成成分やその分解の意義は不明でした。
内容
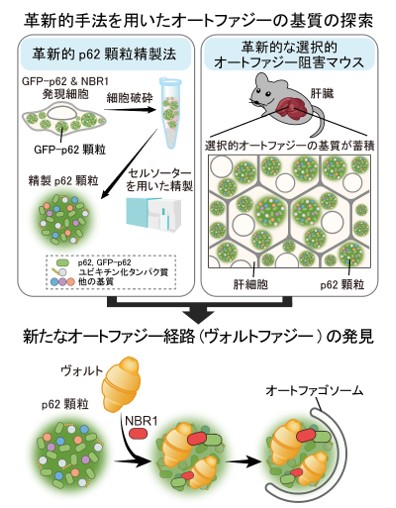
今回、研究グループはp62顆粒を介して選択的オートファジーで分解されるたんぱく質の同定を目的として、まず蛍光標識したp62顆粒をセルソーターを用いて効率よく精製する手法を確立しました(図2)。次に、精製したp62顆粒に含まれるたんぱく質を質量分析により網羅的に同定しました。さらに、革新的な選択的オートファジー阻害マウスの肝臓を用いて、選択的オートファジーで分解されるたんぱく質も網羅的に同定しました(図2)。これら二つの革新的手法で得られた結果を統合的に解析した結果、巨大なたんぱく質複合体ヴォルト(vault)がp62顆粒を介して選択的オートファジーで分解されるというこれまで全く知られていなかった新たなオートファジー経路を見出すことに成功し、この分解経路を「ヴォルトファジー(vault-phagy)」と名付けました(図2)。

今後の展開
これまでにオートファジーの異常は、がんや神経変性疾患などのオートファジー関連疾患の原因となることが示されています。今回研究グループが確立した手法は、これらの疾患の解析にも適応できることから、将来的にがんや神経変性疾患等の病態や発症機序の解明、そしてそれら疾患の治療につながることが期待されます。