発表論文の解説
UBA5のE1様酵素活性を制御するLIR/UFIMを発見
UFM1-activating enzyme 5 (UBA5) required for binding to ubiquitin-like proteins and ufmylation.
Habisov S, Huber J, Ichimura Y, Akutsu M, Rogova N, Loehr F, McEwan DG, Johansen T, Dikic I, Doetsch V, Komatsu M, Rogov VV, Kirkin V.
J Biol Chem. 2016 Feb 29. pii: jbc.M116.715474.
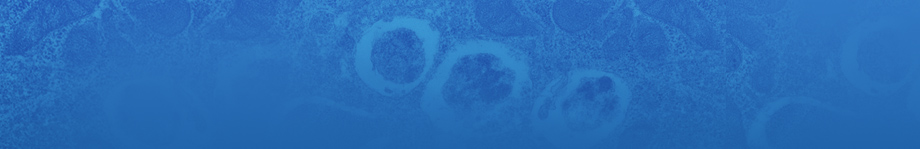
ユビキチン様修飾因子UFM1 (Ubiquitin-fold modifier1) は、UFSP1、またはUFSP2による切断を受けてC末端にグリシンを露出した後、UBA5 (E1様酵素)、UFC1 (E2様酵素)とのチオエステル結合中間体を形成し、UFL1 (E3様酵素)の働きによりUFBP1 (C20orf116)やASC1 (TRIP4)といった標的タンパク質に共有結合されます(図1)。UFM1修飾系は、赤血球分化やエストロゲン受容体 (ERα)を介した転写活性化に必要とされ、関連遺伝子の変異が家族性股関節形成不全症や常染色体劣性小脳失調症で見つかっています。UFM1修飾系の重要性が明らかとなる一方で、その生理的意義や分子メカニズムは依然として謎が多く、病態発症における役割もほとんど理解されていません。
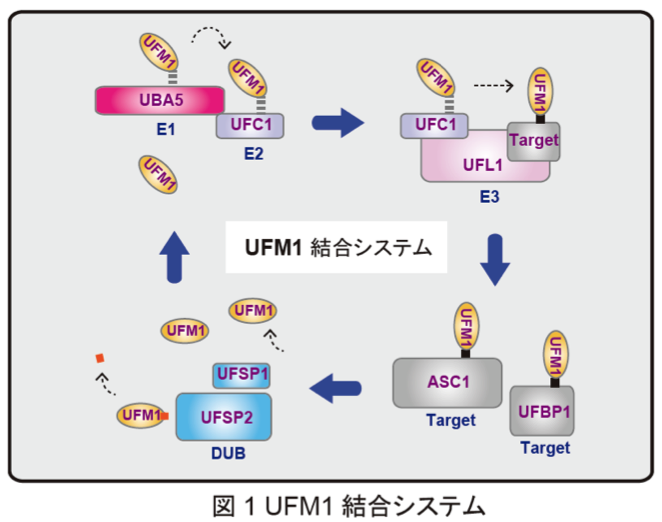
以前より、私たちはオートファジーに関連するユビキチン様タンパク質の1つであるGABARAPL2 (GATE-16)がUBA5と相互作用することを見出していました。しかし、その理由については不明のままでした。今回、私たちはUBA5のC末端近傍にLC3-interacting region (LIR)と類似の配列を見出し、UFM1 interacting motif (UFIM)と名付けました。驚いたことに、UBA5のLIR/UFIMには、GABARAPL2だけでなくUFM1も相互作用しており、両者のUBA5への結合は競合関係にありました。NMRおよびX線結晶構造解析の結果、UFIMは従来のLIRと同様に、GABARAPL2に存在する2つの疎水性ポケットで相互作用していました。一方、UFM1に対しては、ユビキチンフォールドに形成された1つの疎水性ポケット、そしてN末βシート上のアミノ酸との相互作用を利用して結合していました。結果として、UFIMペプチドは、その向きを逆としながらも、GABARAPL2とUFM1のユビキチンフォールドに対して同じような配置状態で複合体を形成していました(図2)。
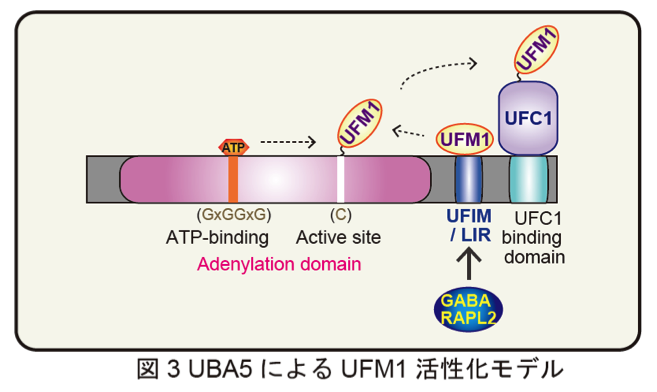
さらに、UFM1結合システムのin vitro再構成系とUBA5欠損HEK293での発現実験の結果、UFIMの相互作用欠損変異体はE1様酵素としての活性が低く、標的タンパク質のUFM化修飾に障害を来たしました。以上の結果は、LIR/UFIMを介したUBA5とUFM1の相互作用が、正常なE1様酵素活性(とくにUFC1への転移反応の触媒)に必要であることを示しています(図3)。GABARAPL2とLIR/UFIMの相互作用は、前述の論理に従うとE1様酵素活性の阻害効果をもたらすことになりますが、現在のところGABARAPL2を過剰発現させた細胞でもUBA5のE1様酵素活性の阻害は確認されておりません。今後さらに、UFM1修飾系の活性変動を伴うような生理条件下で、GABARAPL2がUBA5の活性を制御する可能性について検証する必要があると考えています(図3)。なお本研究成果は、Merck Serono社のVladimir Kirkin博士らのグループとの共同研究によるものです。