発表論文の解説
p62のスプライシングによるKeap1-Nrf2システムの抑制
Negative regulation of the Keap1-Nrf2 pathway by a p62/Sqstm1 splicing variant.
Kageyama S, Saito T, Obata M, Koide RH, Ichimura Y, Komatsu M.
Mol Cell Biol. 2018 Jan 16; [Epub ahead of print]
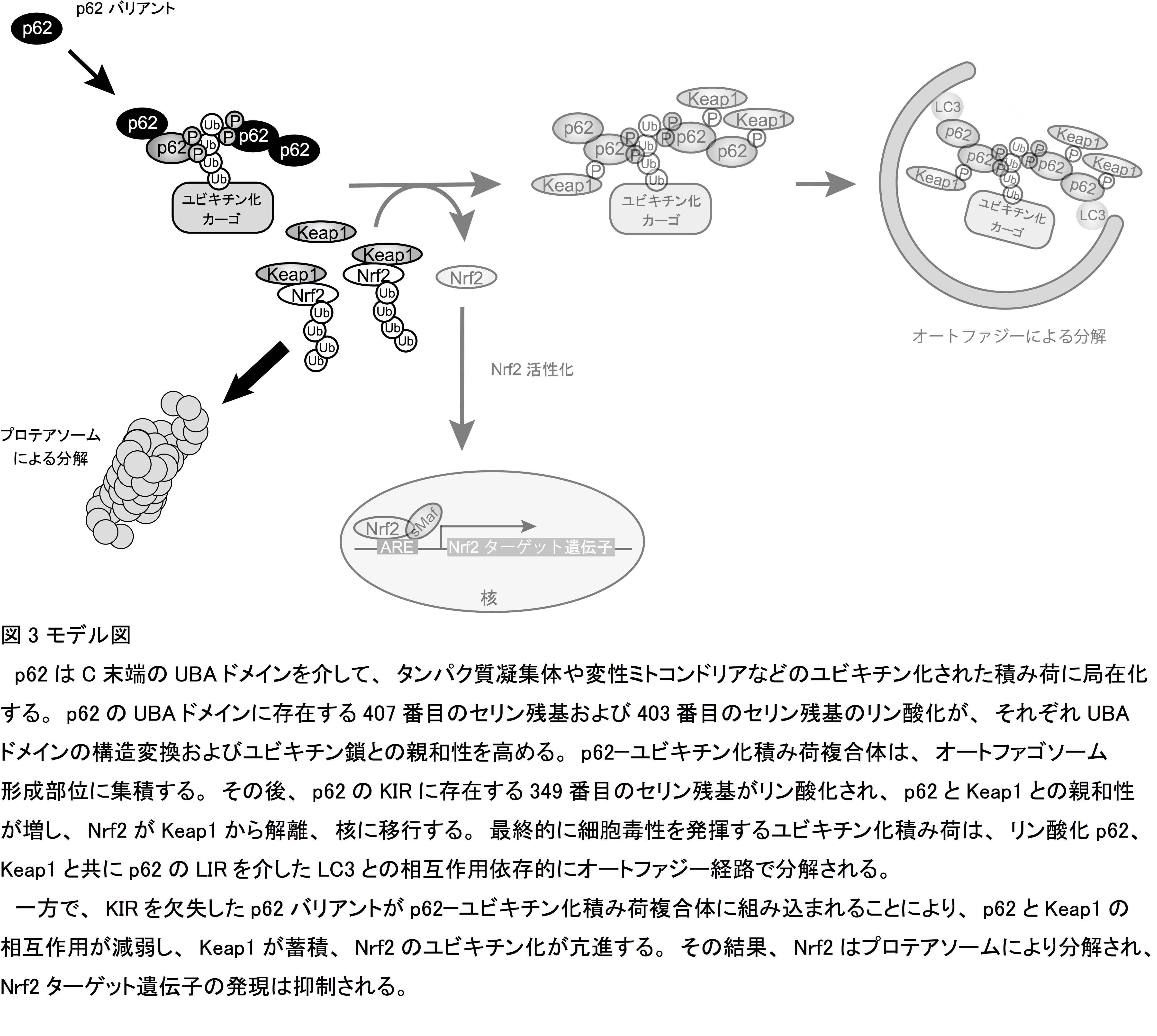
Keap1-Nrf2システムにおいて、Keap1はユビキチンリガーゼ(正確にはCullin 3型ユビキチンリガーゼのアダプタータンパク質)として働き、Nrf2は転写因子として生体防御酵素群の遺伝子発現を調節する。即ち細胞が活性酸素や親電子性物質などのストレスに曝されると、Keap1がセンサーとして働き、Nrf2の分解を停止して、Nrf2が活性化します。一方、p62はオートファジーによる量的制御およびリン酸化やユビキチン化などの質的制御によりNrf2と競合的にKeap1と結合、不活性化し、Nrf2を活性化することがわかっています (Komatsu et al., NCB 2010, Ichimura et al., Mol. Cell 2013)。
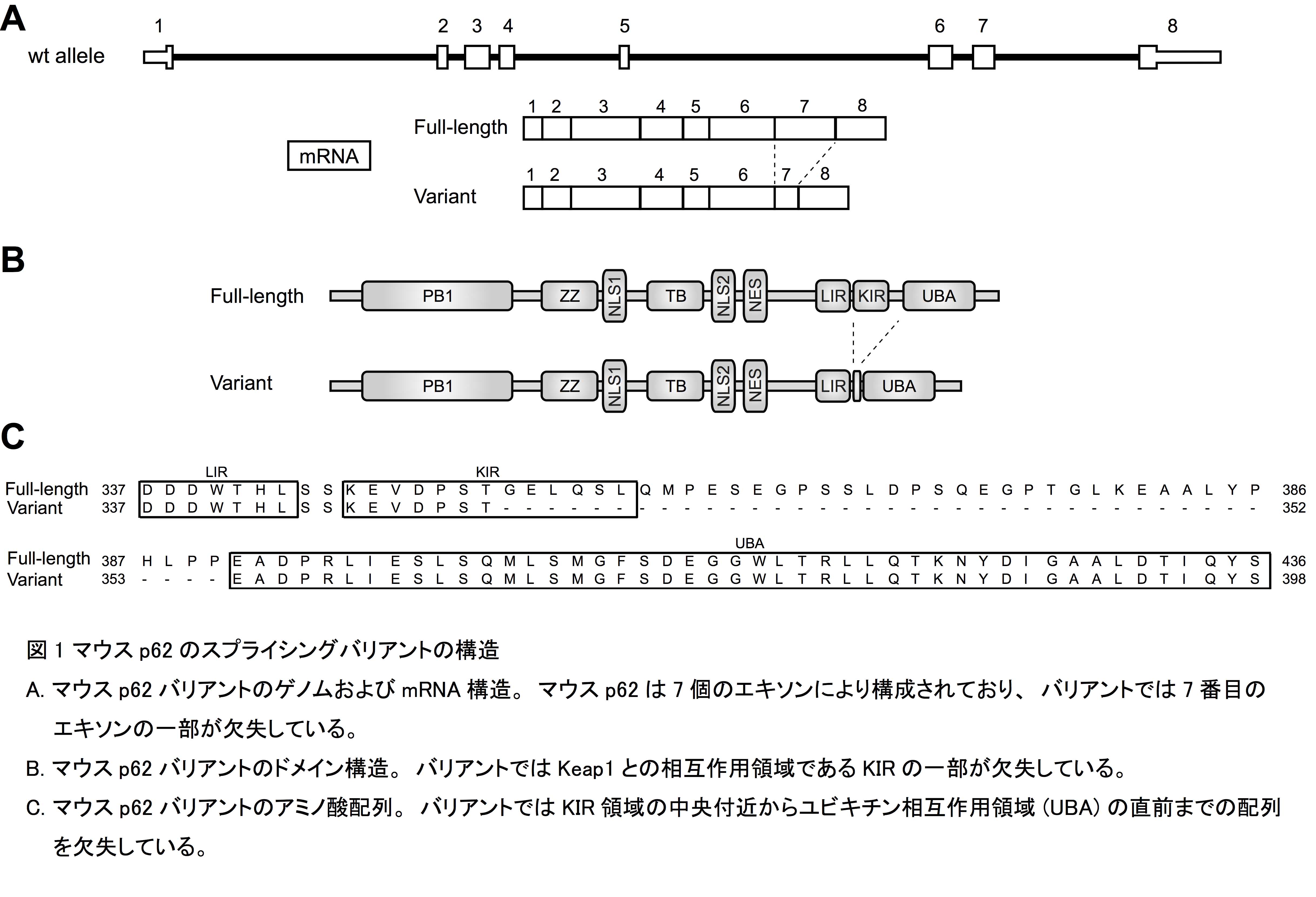
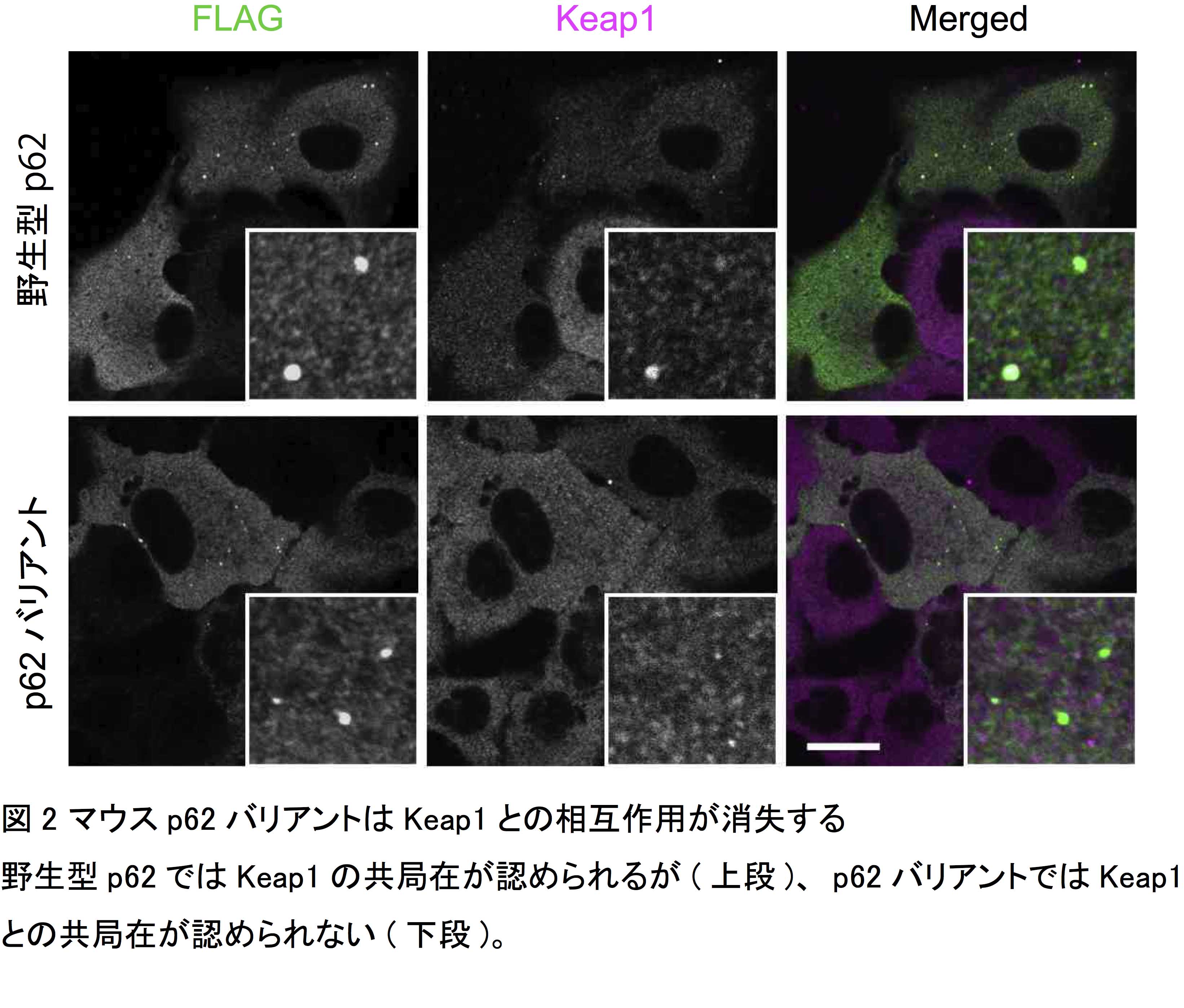
私たちは、マウスのゲノムデータベースにおいてKeap1との相互作用領域の一部を欠失したp62スプライシングバリアントが登録されていることに気がつきました(図1)。