発表論文の解説
AlphaFold2-Multimerから明らかになったUFM1 E3複合体の役割
Mechanistic insights into the roles of the UFM1 E3 ligase complex in ufmylation and ribosome-associated protein quality control
Ishimura R#, Ito S#, Mao G, Komatsu-Hirota S, Inada T*, Noda NN*, Komatsu M*.
(#co-first authors, *co-corresponding authors)
Sci Adv. 2023 Aug 18;9(33):eadh3635. doi: 10.1126/sciadv.adh3635.
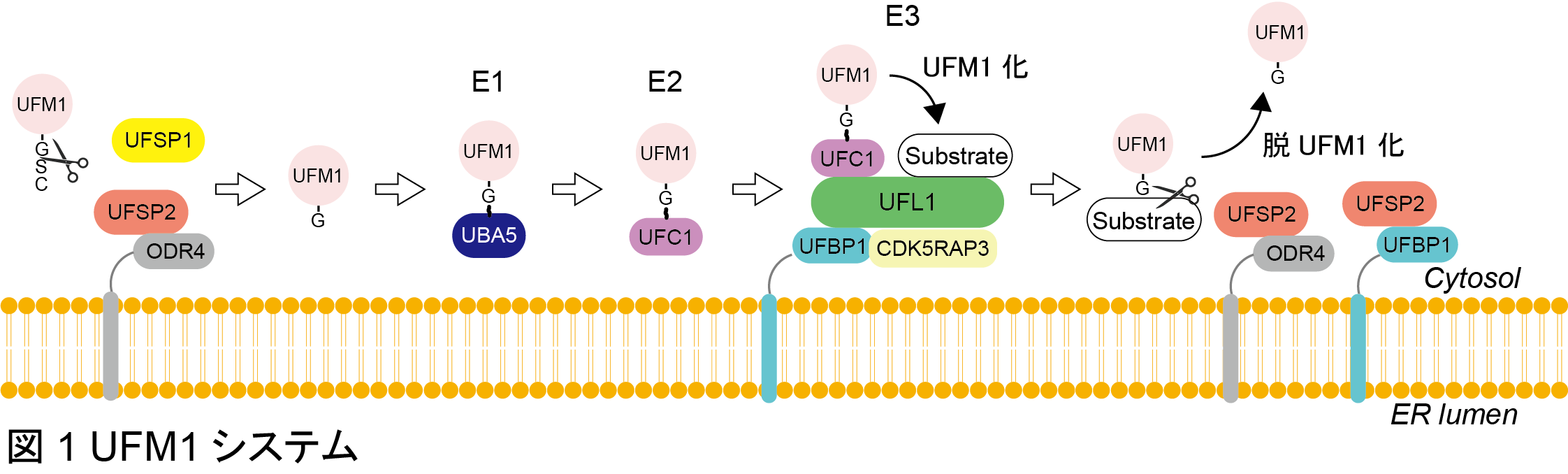
Ubiquitin-fold modifier 1 (UFM1)システムは、2004年に小松らにより発見されたユビキチン様修飾反応系です。UFM1は、合成直後にシステインプロテアーゼであるUFSP1、2によりC末端を切断されグリシン残基が露出した成熟型となります。成熟型UFM1は、UFM1特異的E1酵素であるUBA5と高エネルギーチオエステル結合を形成し、活性化されます。活性化UFM1は、UFM1特異的E2酵素であるUFC1に転移され、最終的に小胞体に局在するE3酵素UFL1-UFBP1-CDK5RAP3複合体を介して標的タンパク質に共有結合されます(UFM1化)。UFM1化は可逆的であり、基質と結合したUFM1は小胞体に局在するUFSP2により脱UFM1化されます(図1)。
UFM1システムは、原生動物から高等動植物に至るまで真核生物に広く保存されており、その生物学的重要性が示唆されてきました。事実、私たちはマウス遺伝学的解析により世界に先駆けてUFM1システムが神経発生・脳形成に不可欠であることや、小児てんかん性脳症患者の遺伝子解析からUFM1、UBA5、UFC1をコードする遺伝子変異がUFM1化の減弱を伴った遺伝性小児脳症をきたすことを明らかにしてきました。最近、小胞体上でリボソームタンパク質RPL26がUFM1化されること、そしてこのUFM1化が小胞体上で合成が停止した新生ポリペプチドの分解(小胞体におけるリボソーム品質管理機構:ER-RQC)に関与することが判明しました(Walczak et al., PNAS 2019, Wang et al., Cell Res 2019, Cell Rep 2023)。一方、ゲノムワイドなスクリーニングなどによりUFM1システムがオートファジーによる小胞体分解(ER-phagy)を制御することもほぼ同時期に報告されました(Liang et al., Cell 2020, Stephani et al., Elife 2020, Picchianti et al., EMBO J 2023)。しかし、UFM1システムが小胞体上の異なる細胞機能を制御するメカニズムはほとんど不明でした。
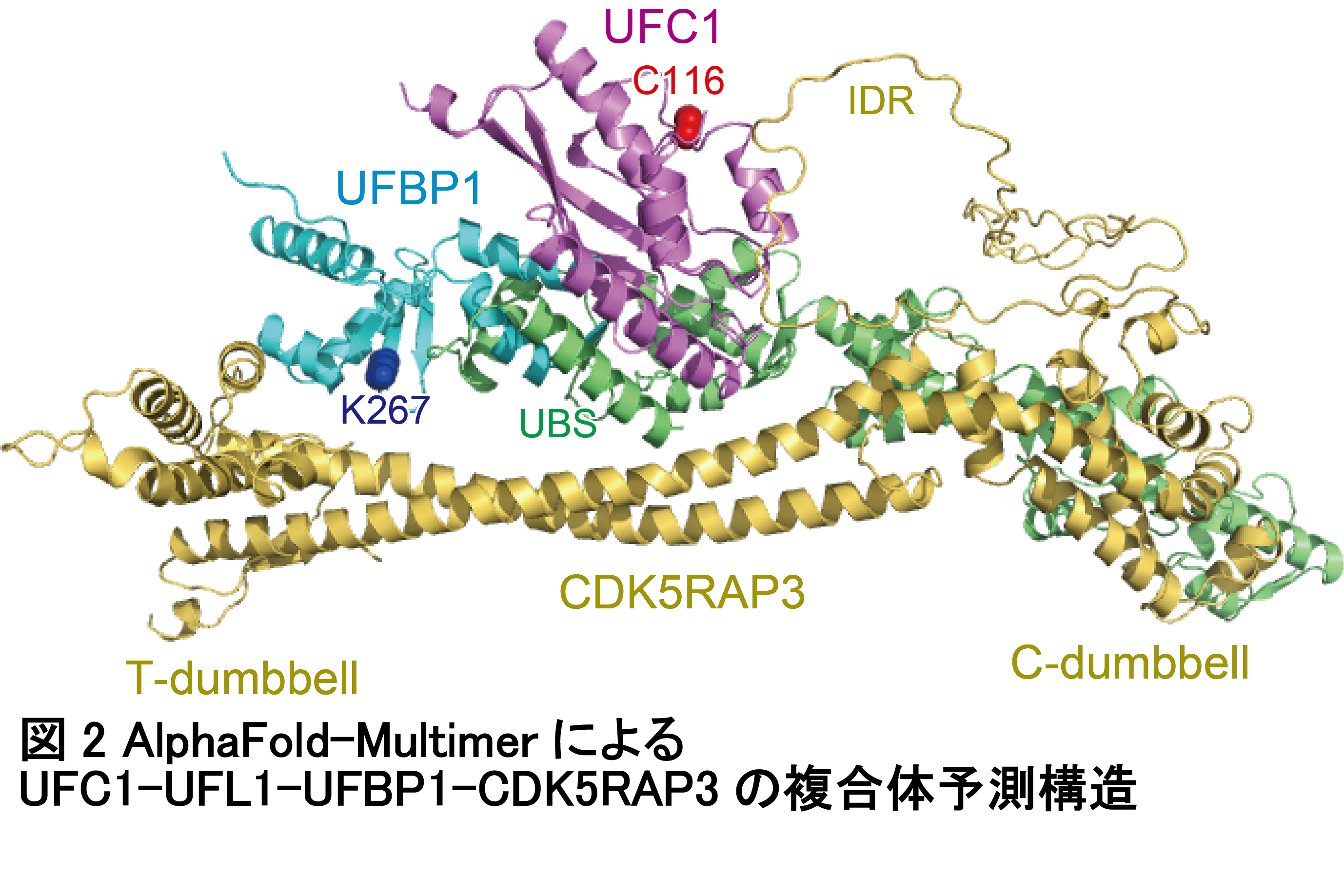
今回、人工知能プログラムAlphafold-Multimerによる複合体予測より、UFM1、UFC1 (E2)、UFL1 (E3 サブユニット) 、UFBP1 (E3サブユニット) 、 CDK5RAP3 (E3調整サブユニット)、の5者複合体の構造が高い信頼性で予測できました(図2)。
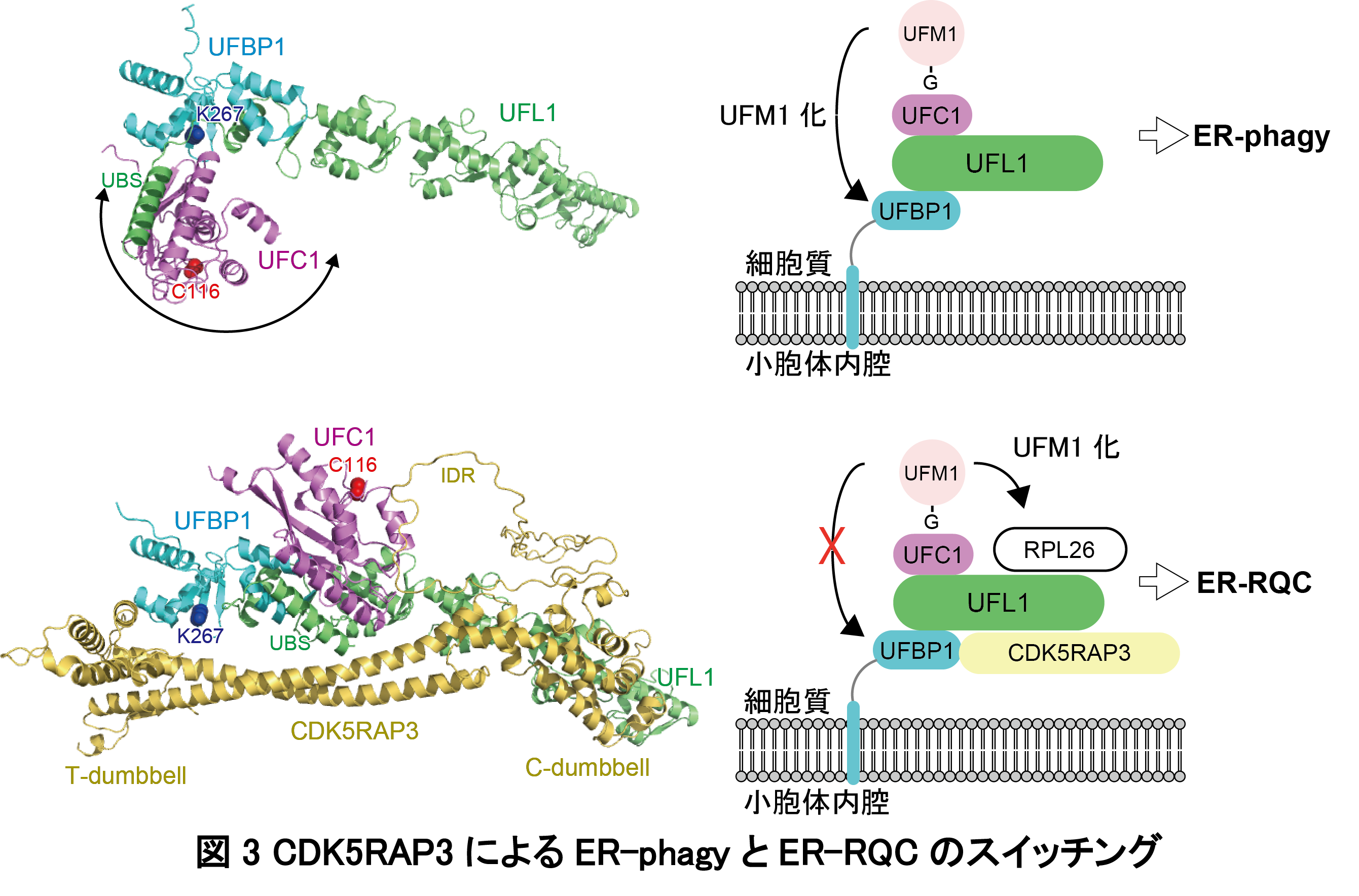
各種結合変異体を作製し、構造予測の裏付けを取るとともに、それら複合体形成の意義を明らかにしました。つまり、UFM1 連結酵素であるUFL1と小胞体に局在するUFBP1とが安定に複合体を形成すること、その複合体にCDK5RAP3が結合すると小胞体上で翻訳が停止したリボソーム60SのRPL26にUFM1が連結されることが明らかになりました。これは、Kulathu、Kopitoらのグループが報告したin vitro再構成系のデータと一致していました(Peter et al., EMBO J 2023)。さらに、このUFM1 E3複合体(UFL1-UFBP1-CDK5RAP3複合体)は、複合体中のUFBP1に含まれるUFM1結合モチーフ(UFM1-interacting motief: UFIM)を介してUFM1が連結されたRPL26に結合すること、このUFIMを介した結合が小胞体における合成途中の新生ポリペプチド分解(ER-RQC)に必要であることが明らかになりました。一方、CDK5RAP3がUFM1 E3複合体に結合しない場合、E3サブユニットであるUFBP1にUFM1が連結され、これが小胞体のオートファジー分解に働くことが示唆されます(図3)。
2004年にUFM1システムが発見されて以来、その細胞機能制御の解明は長らく待たれていました。この5年間で目覚ましい進展があり、小胞体の機能と維持におけるUFM1システムの重要性が確立されました。しかし、UFM1システムの新たな理解は、さらに多くの問題を提起しています。ER-RQCの過負荷は、ER-phagyを促進すると想定されますが、その根底にあるメカニズムはほとんどわかっていません。さらに、UFM1 E3複合体が連結酵素として機能する他、60SサブユニットのUFM化されたRPL26との安定な結合がER-RQCに必要であることが示されました。しかし、この安定な結合がどのようにER-RQCに関与するのかは全くの不明であり、今後詳細を調べていく予定です。