JUNTENDO News&Events ニュース&イベント
2025.04.30 (WED)
- 順天堂大学について
- 研究活動
- メディアの方へ
- 企業・研究者の方へ
- 医学部
- 医学研究科
潰瘍性大腸炎に対する腸内細菌移植療法 “良いドナーの条件”と“ドナーと患者の相性”を解明 ~ 新規治療「腸内細菌療法」の確立に向けて ~
順天堂大学 大学院医学研究科腸内細菌療法リサーチセンターの石川大 センター長、医学部消化器内科学講座の永原章仁 教授、とメタジェンセラピューティクス株式会社の山田拓司 最高科学顧問らによる研究グループは、潰瘍性大腸炎(Ulcerative Colitis:UC)の新たな治療法として注目されている「腸内細菌叢移植療法(Fecal Microbiota Transplantation:FMT)」について、治療効果およびその効果に関与する「良いドナー」の条件、ならびに患者とドナーの腸内細菌叢*1のマッチングの重要性を明らかにしました。潰瘍性大腸炎は、原因不明の慢性炎症性腸疾患であり、厚生労働省指定の難病です。その発症には腸内免疫と腸内細菌叢のバランス異常が関係しているとされており、健康なドナーから提供される腸内細菌を移植するFMTが新たな治療選択肢として期待されています。
本研究では、2014年から実施されてきたFMTの臨床研究に参加した97例の潰瘍性大腸炎患者のデータを詳細に解析しました。その結果、FMTの治療効果は患者の病勢の重症度や過去の薬剤使用歴と関連していることが明らかになりました。また、治療効果が高かったドナーには特定の有用菌種*2が存在しており、さらにそのドナーと患者の腸内細菌叢の構成が類似している場合、治療効果が高い傾向があることが確認されました。
これらの知見は、FMTによる治療のさらなる効果向上を可能にし、将来的には個々の患者に最適化された個別化医療(パーソナライズド・メディスン)への展開が期待されます。
本論文は「Journal of Crohn’s and Colitis」誌に2025年4月1日付で公開されました。また、国際学会(アメリカ消化器病学会、ヨーロッパ腸炎学会、日本消化器病学会など)にて口演発表され、高い評価を受けております。
本研究成果のポイント
- FMT臨床研究に参加した潰瘍性大腸炎97症例を解析し、患者の重症度と薬剤使用歴がFMTの治療効果に影響することがわかった。
- 「Oscillospiraceae UCG−002」や「Alistipes」などの有用菌種が豊富なドナーからの移植が有効であり、ドナー由来の特定菌種が腸内に定着することで長期的な寛解が得られることがわかった。
- 特定の菌群(酪酸産生菌やBacteroidota門)において患者とドナーの株組成が似ていることが、FMTの治療効果に影響することが明らかとなった。
■背景
― 抗菌薬前処置を併用したFMTの世界初大規模検証研究 ―
潰瘍性大腸炎(UC)は、腹痛、頻回な下痢、血便を主な症状とする難病指定疾患であり、日本国内には20万人を超える患者がいるとされています。原因は未だ明らかになっておらず、過剰な自己免疫反応が関与していることから、現在の治療法は免疫抑制剤やサイトカインを標的とした薬剤療法が中心であり、根本的な治療法は確立されていません。本疾患は腸の粘膜に慢性的な炎症を引き起こし、腸内の有益な細菌が著しく減少することで腸内環境のバランスが崩れることが知られています。近年、この腸内環境を根本から立て直す新たな治療法として注目されているのが「腸内細菌叢移植療法(Fecal Microbiota Transplantation:FMT)」です。FMTは、健康なドナーから提供された便を患者に移植し、多様な腸内細菌を補うことで腸内フローラを再構築する治療法です。しかしながら、FMTの治療効果には個人差が大きく、「どのドナーが最も適しているのか」「患者とドナーの相性は何によって決まるのか」「治療の最適なタイミングはいつか」といった多くの疑問が未解明のままでした。
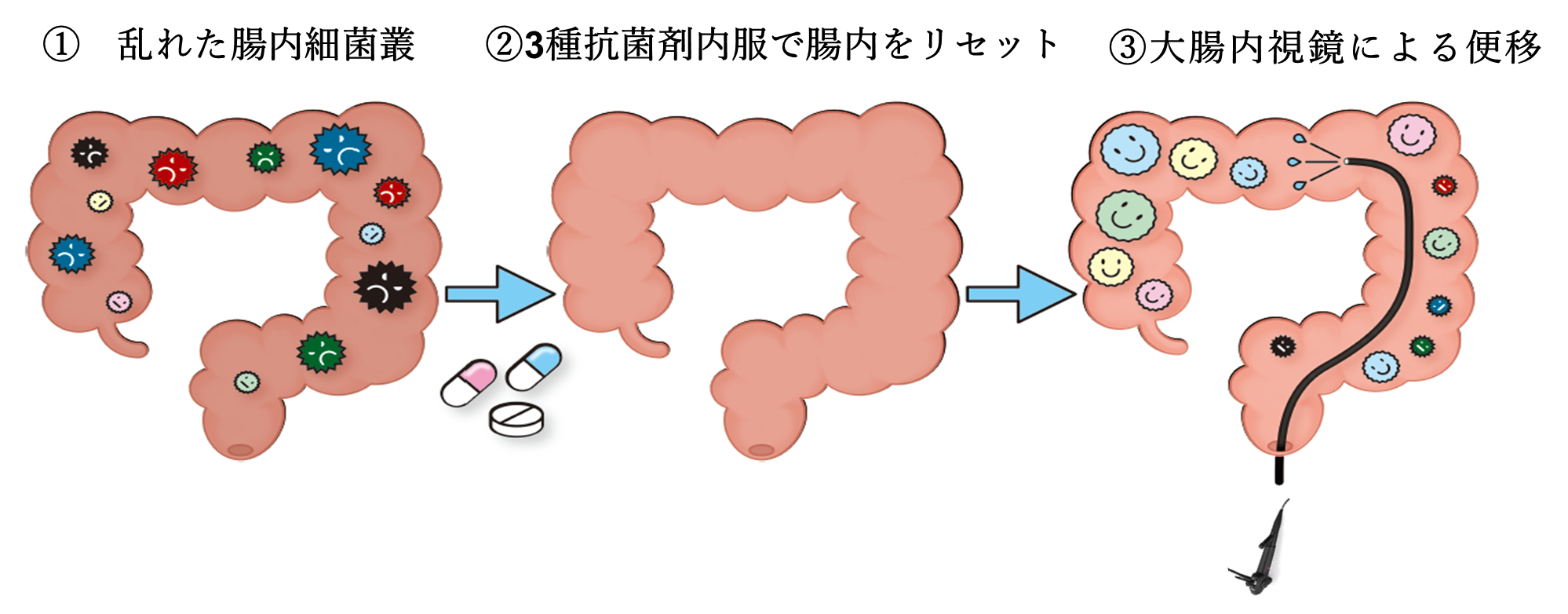
こうした課題に対し、私たちの研究グループは、FMTの前処置として抗菌薬を用いることで、患者の腸内に存在する既存の細菌を一時的に除去し、ドナー由来の有用菌がより効果的に定着する環境を整える「抗菌薬併用腸内細菌移植療法FMT(A-FMT)」*3という新たな戦略を開発しました。さらに本研究では、患者ごとに異なるドナーを組み合わせる「1対1戦略」に基づき、FMTの効果を最大化する条件を大規模に検証する研究を行いました。
■内容
本研究では、便移植前にアモキシシリン、ホスホマイシン、メトロニダゾールの3種類の抗菌薬を2週間服用し、腸内の既存細菌を一時的に減らしたうえでFMTを行う抗菌薬併用腸内細菌移植療法(A-FMT)という治療法を用いました。この前処置により、ドナー由来の細菌がより定着しやすくなる「腸内の空白地帯(ニッチ)」を形成し、移植効果の増強を目指しています。
研究には、2014年から2019年までにFMT臨床研究に参加した活動期UCの患者97名について、FMT後4週間の症状改善や、12か月以内の再燃の有無などに基づき、短期・長期の治療効果を評価しました。さらに、それぞれドナーの異なる患者とドナーの49の組み合わせ、147検体の便サンプル(患者治療前、治療後、ドナー)について、腸内細菌の網羅的な遺伝子解析(16S rRNA遺伝子解析)を実施し、その結果、61名(63%)が臨床的な改善を示し、うち35名(36%)は寛解(症状が落ち着いた状態)に至りました。(図1)
興味深いことに、FMTの効果はUCの重症度や過去の薬剤使用歴(ステロイド、免疫抑制剤、生物学的製剤)にも影響されることが分かりました。また、有効なドナーには、UC患者で減少している「Bacteroidota門」などの細菌群が豊富に存在していること、逆に、患者自身の腸内由来の細菌や治療後に新たに出現する未同定菌の量が少ないことが、治療成功の指標となることも判明しました。特に、「Alistipes」や「Oscillospiraceae UCG-002」などのドナー由来菌が治療効果に強く関連しており、腸内の酪酸産生菌(短鎖脂肪酸を作り出す善玉菌)の存在も効果を左右していることが明らかになりました。さらに、患者とドナーの腸内細菌において、特定の酪酸産生菌やBacteoridota門の株組成の類似性が高いほど、FMT後の定着と治療効果が高い傾向にあることも明らかになりました。(図2)
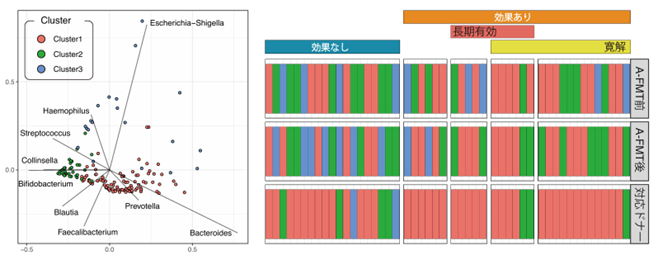
図1:有効なドナーの腸内細菌叢組成
細菌叢とクラスター(グループに分ける)解析すると、3つのグループ(Cluster1,2,3)に分かれます。①治療効果が大きい患者(寛解導入)のドナーと治療後の患者は全てBacteroidotaが多く含まれるCluster1か2だった。②Proteobacteriaが多く含まれるCluster3のドナーの場合は治療効果なしであった。この結果は、UC治療において有効なドナーの腸内細菌の条件を明らかにしました。
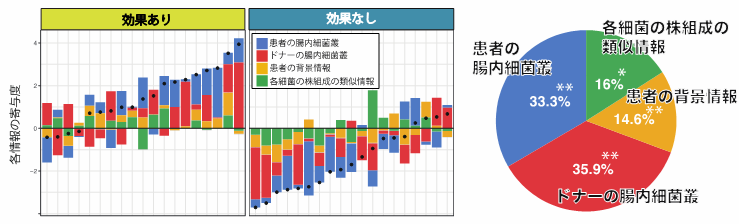
図2:FMTの治療効果に影響を与える要因の検討
FMTの治療効果はドナーの腸内細菌構成だけでなく、治療前の患者の腸内細菌叢やドナーと患者との腸内細菌叢の「類似性」にも影響されることが分かりました。FMTに良好な反応を示した患者(Responder)では、ドナーと患者の間で、特定の4つの属および3つの科において微生物構成の高い類似性が認められました。このことは、移植前の段階で患者とドナーの腸内環境がどれほど近いかが、治療効果に大きく影響する可能性を示唆しています。
こうした背景から、FMTは単なる腸内細菌の移植にとどまらず、腸内細菌叢の構成をもとに適切なドナーを選定する「精密医療(プレシジョン・メディシン)」としての応用が期待されています。特に、Bacteroides属や酪酸産生菌を中心とした細菌構成が類似しているドナーの選択は、より高い治療効果につながる可能性があります。
■今後の展開
本研究は、FMT(腸内細菌移植療法)をより効果的に実施するための「最適なドナーの条件」および「患者とのマッチング戦略」を明らかにし、潰瘍性大腸炎(UC)に対する個別化医療(プレシジョン・メディスン)としてのFMTの可能性を大きく広げる成果となりました。特に、抗菌薬併用FMT(A-FMT)においては、ドナー由来の有用菌が患者の腸内に定着することによって治療効果が得られることが示唆されましたが、その定着を成功させるためには、患者側の腸内環境や背景因子との適合性が重要な要素となります。また、Bacteroidota門や酪酸産生菌など、共通した腸内細菌プロファイルを有するドナーがより効果的であることが明らかになりました。これにより、今後のドナー選定においては「有効な菌の保有」に加えて、「患者との微生物学的な類似性」も重視されることが示唆されます。
これらの知見は、FMTを単に実施するだけでなく、「どの患者に」「いつ」「どのドナーの便を使用するか」といった戦略的な判断が、治療成績に大きく影響することを示しています。将来的には、より高精度な腸内細菌叢解析技術と、ドナー・レシピエント間のマッチングアルゴリズムの進展により、個別化FMT治療の標準化と最適化が期待されます。本研究結果は、マイクロバイオーム治療の未来に向けて、より精密かつ戦略的な医療アプローチの確立に貢献するものであり、UC患者に対する新たな治療選択肢を提供する重要な一歩となると考えられます。
■用語解説
*1 腸内細菌叢
ヒトの腸管には約1,000種、数40兆個以上の腸内細菌が生息しており、その細菌の集団を腸内細菌叢(腸内フローラ)と言います。近年、腸内細菌叢全体の遺伝子組成や機能特性が解明されつつあり、腸内細菌の研究は著しい発展を遂げています。腸内細菌研究が進む中、腸内細菌叢の乱れが炎症性腸疾患や過敏性腸症候群といった消化器疾患だけでなく、肥満や糖尿病などの代謝性疾患、アトピー性皮膚炎などのアレルギー疾患、自閉症やうつなどの精神疾患といった様々な疾患に関与していることが明らかになってきています。
*2 有用菌種
本研究においては「Alistipes」や「Oscillospiraceae UCG-002」などのドナー由来の菌種に注目しています。「有用菌」とは、私たちの腸内に存在し、健康を維持するうえで役立つ細菌のことを指します。たとえば、腸の中で炎症を抑えたり、腸内環境を整えたりする働きをもつ菌がこれにあたります。具体的には、食物繊維を分解して短鎖脂肪酸(例:酪酸)を作り出し、腸の粘膜を保護したり、免疫のバランスを調整したりする菌が含まれます。これらの菌は、腸内細菌のバランスが乱れている患者にとって、健康な状態を取り戻す手助けをする「善玉菌」のような存在です。
*3 抗菌剤併用腸内細菌叢移植療法(A-FMT療法)
*関連プレスリリース:2020年6月25日 順天堂大学「兄弟、同世代のドナーが便移植療法の長期治療効果を高める」
①~③の3つのステップからなります。①乱れた腸内細菌叢の状態:腸内細菌のバランスが乱れ、多様度が低下しています。②抗生剤の服用で腸内細菌叢をリセット:抗菌剤3種の服用(AFM療法)により腸内細菌量を極限まで減らし、乱れた腸内細菌叢をクリアにします。③内視鏡による便移植:ドナー便から生成した腸内細菌溶液の注入により、バランスのとれた腸内細菌叢の構築を図ります。
*順天堂大学腸内細菌療法リサーチセンター(Gut-Link Lab)
近年注目されている腸内細菌叢の乱れ(dysbiosis)を是正する治療法「腸内細菌療法」の基礎研究と臨床応用を推進するために2025 年1月に設置されました。FMTを含む腸内細菌を利用した治療は消化器疾患だけでなく、他領域への応用可能性が広がっており、多分野の専門家が連携(Link)することで、効率的かつ高品質な臨床研究と基礎研究を横断的に展開しています。また、腸内細菌療法の国際的研究拠点としての地位確立を目指しており、国内外のアカデミア・企業との連携(Link)も強化しています。
年1月に設置されました。FMTを含む腸内細菌を利用した治療は消化器疾患だけでなく、他領域への応用可能性が広がっており、多分野の専門家が連携(Link)することで、効率的かつ高品質な臨床研究と基礎研究を横断的に展開しています。また、腸内細菌療法の国際的研究拠点としての地位確立を目指しており、国内外のアカデミア・企業との連携(Link)も強化しています。
研究者のコメント
腸内細菌サイエンスの飛躍的な進展により、さまざまな疾患の発症や増悪が腸内環境と密接に関係していることが明らかになりつつあります。そのような背景のもと、腸内細菌叢を根本的に入れ替える腸内細菌移植(FMT)は、多くの疾患に対して研究・臨床応用が急速に進んでいます。本学では2014年より潰瘍性大腸炎を対象としたFMTの臨床研究を開始し、2023年には本治療法が「先進医療B」として厚生労働省に承認されました。これまでに250名を超える潰瘍性大腸炎患者さんと、200名以上の健康なドナーの皆さまにご協力をいただき、貴重な臨床データを蓄積しています。今回の研究成果を礎に、より多くの患者さんに安全かつ効果的な腸内細菌療法を届けられるよう、引き続き精力的に研究と社会実装の両面を推進してまいります。私たちは、腸内環境の再構築による新たな治療戦略が、未来の医療の選択肢として確立されることを目指しています。
■原著論文
本研究は「Journal of Crohn’s and Colitis」誌に2025年4月1日付で公開されました。
タイトル: Patient–donor similarity and donor-derived species contribute to the outcome of faecal microbiota transplantation for ulcerative colitis
タイトル(日本語訳): 潰瘍性大腸炎に対する腸内細菌叢移植の治療効果における患者・ドナー間の腸内細菌類似性およびドナー由来菌種の寄与
著者:Dai Ishikawa, Hikaru Watanabe, Kei Nomura, Xiaochen Zhang, Takafumi Maruyama, Rina Odakura, Masao Koma, Tomoyoshi Shibuya, Taro Osada, Shinji Fukuda, Taku Nakahara, Jun Terauchi, Akihito Nagahara, Takuji Yamada
著者(日本語表記):石川大1)2)、渡邊日佳流3)、野村慧1)2)、張暁晨1)2)、丸山貴史1)2)、小田倉里奈1)2)、髙馬将郎1)2)、澁谷智義2)、長田太郎2)、福田真嗣3)4)5)6)、中原拓3)、寺内淳3)、永原章仁1)2)、山田拓司3)
著者所属:1)順天堂大学大学院医学研究科腸内細菌療法リサーチセンター、2)順天堂大学医学部内科学教室・消化器内科学講座、3)メタジェンセラピューティクス株式会社、4)慶應義塾大学先端生命科学研究所、5)神奈川県立産業技術総合研究所、6)筑波大学トランスボーダー医学研究センター
DOI:10.1093/ecco-jcc/jjaf054
本研究はJSPS科研費JP16K09328、および協和キリン株式会社、 協和発酵バイオ株式会社、 キリンホールディングス株式会社、メタジェンセラピューティクス株式会社共同研究講座研究費、 国立研究開発法人日本医療研究開発機構(AMED)JP21ae0121038の支援を受け実施されました。
なお、本研究にご協力いただいた皆様には深謝いたします。