
|
研究
|
タイトルをクリックをしますと内容が表示されます
中枢神経系胚細胞腫のゲノム解析
|
頭蓋内原発の胚細胞腫瘍(中枢神経系胚細胞腫)は10代をピークとして小児に好発する腫瘍です。欧米ではまれな腫瘍であり、米国脳腫瘍統計(CBTRUS
200-2008)によれば14歳以下の小児に発生する脳腫瘍の3.6%にすぎません。一方東アジアでは比較的多く、特に日本においては14歳以下の小児頭蓋内腫瘍の中の15.4%を占め、星細胞腫に次いで2番目に高頻度に見られる腫瘍です。
中枢神経系胚細胞腫はWHO分類によればジャーミノーマ、奇形腫、卵黄嚢腫瘍、絨毛癌と胎児性癌の5つの亜型に分けられ、それぞれの組織型が混在する混合型もしばしばみられます。胚細胞腫の発生機序、特に異なった組織型がしばしば混在する理由については不明です。これら亜型の中でジャーミノーマは最も頻度が高く(約50%)、放射線治療と化学療法にも反応することが多いのですが、その他の悪性胚細胞腫瘍は治療に抵抗性を示し、転移、髄膜播種なども起こしやすく予後は不良です。このように臨床的に重要な腫瘍であるにもかかわらず、遺伝子解析を行った研究は国際的にも極めて限られており、その病態はいまだ謎に包まれています。
本研究では中枢神経系胚細胞腫の病態を解明し、診断、治療反応性および予後の予測などに有用な新たな分子腫瘍マーカーと、腫瘍特異的な治療に応用可能な分子標的を発見することを目的としています。この目的のため、全国規模の多施設共同研究を行う基盤として、2011年に頭蓋内胚細胞腫ゲノム解析コンソーシアム
(iGCT)
を設立しました。現在50施設以上が参加するコンソーシアムを通じて300例以上の中枢神経系胚細胞腫の検体を集め、次世代シーケンスによる全ゲノム的遺伝子変異解析、染色体異常解析、DNAメチル化解析、発現プロファイリングなどさまざまな方向から胚細胞腫の遺伝子解析を行っています。
これらのうち41例の中枢神経系胚細胞腫でエクソームシークエンスを行い、さらに83例のCNS
GCT、65例の精巣胚細胞腫、8例の転移性胚細胞腫で標的シークエンスを行ったところ、KIT,
RAS以外にもMAPK経路の遺伝子およびMTORなどPI3K経路の点突然変異が全体の約50%に見られることを発見し、MAPK/PI3K経路の活性化が胚細胞腫の発生機序に重要な役割を果たしていることを報告しました(図1)。また変異型MTORは活性が亢進しており、その活性はMTOR阻害剤により抑制されることから、これらの変異を持つ難治性の胚細胞腫には標的阻害剤が有効である可能性が示唆されました
(Ichimura, Acta Neuropathol 2016)。
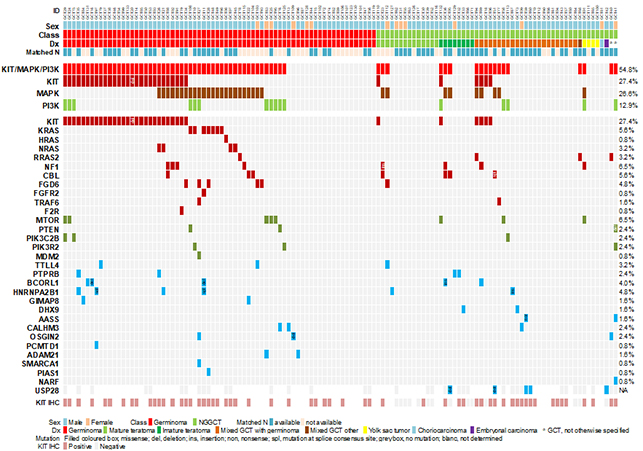
図1.
124例の中枢神経系胚細胞腫におけるエクソーム・標的シークエンスの結果(Ichimura
et al. Acta Neuropathol 2016より)
次に61例の中枢神経系胚細胞腫に対してゲノムワイドにメチル化解析を行ったところ、ジャーミノーマではゲノム全体に広範な低メチル化が認められた。このメチル化プロファイルはマウスの始原生殖細胞(primordial
germ cell,
PGC)と相同性が高く、中枢神経系胚細胞腫のうち少なくともジャーミノーマについてはPGC由来である可能性が高いことが示唆されました
(Fukushima, Acta Neuropathol, 2017)。
さらに全トランスクリプトーム解析により、ジャーミノーマがPGCと同様のRNA発現プロファイルを持つのに対し、非ジャーミノーマ胚細胞腫(NGGCT)は胚性幹細胞(ESC)と同様の発現プロファイルを示し、ジャーミノーマとNGGCTが別々の分化の経路をたどることが示唆されました(Takami,
Neuro Oncol 2022)。
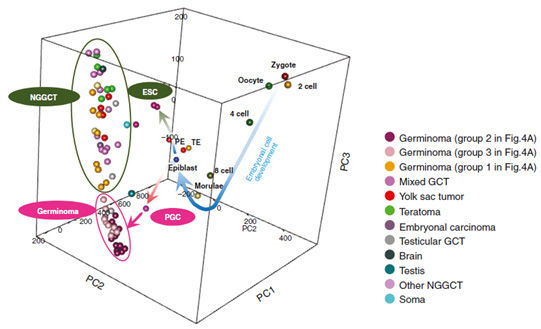
図2.
84例の中枢神経系胚細胞腫における発現プロファイルに対して3次元主成分解析を行った結果(Takami
et al. Neuro Oncol 2022より)
また世界最大規模となる190例の中枢神経系胚細胞腫において臨床所見と遺伝子所見を比較した結果、MAPK経路の変異を持つ胚細胞腫は男性に多く見られ、また基底核部の胚細胞腫ではPI3K経路の変異がより多く見られることを報告しました(Takami,
Neuro-Oncol
2019)。さらに100例のgerminomaにおいて浸潤リンパ球の解析を行ったところ、腫瘍組織における浸潤リンパ球の割合が多い症例は予後がよい傾向にあり、また浸潤リンパ球にはB-cell,
T-cell,
NK-cellなど様々な種類が見られることが分かりました。多くのgerminomaにおいてPD-1,
PD-L1の発現が認められました (Takami, Neuropathol Appl
Neurobiol, 2019;Takami, Neurooncol Adv
2021)。染色体12番短腕(12p)のコピー数増加が、胚細胞腫の悪性非ジャーミノーマ成分の存在を示唆し、予後不良を予測する因子であることも明らかにしました(Satomi,
Neuro Oncol 2022)。
中枢神経系胚細胞腫が日本を含む東アジアで多いことについて、何らかの遺伝的背景があることを解明する目的で、大阪大学、国立成育医療研究センター、埼玉医科大学国際医療センターなどとの共同研究により、133例の日本人の中枢神経系胚細胞腫症例に対してゲノムワイド関連解析を行ったところ、染色体6番に位置するBAK1遺伝子のエンハンサー領域の塩基多型が関わっていることを発見しました(Sonehara,
Nature Commun
2022)。BAK1はアポトーシスの促進に関わっていることが知られていますが、リスク多型となるBAK1エンハンサー領域の4塩基の欠室によりBAK1の発現が抑制されることを示しました。この塩基多型はヨーロッパに比べて東アジアで頻度が高いため、中枢神経系胚細胞腫が東アジアに多い理由に関連していることが示唆されました。この結果は順天堂大学のホームページでプレスリリースが公開されました。 
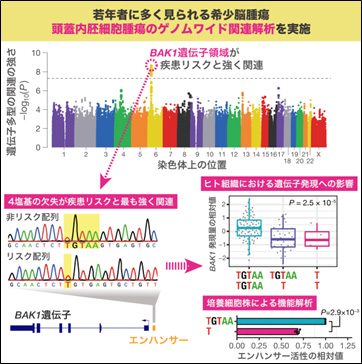
図3.133例の中枢神経系胚細胞腫におけるゲノムワイド関連解析の結果(プレスリリースより)
|
成人グリオーマの遺伝子解析と分子診断
|
グリオーマ(神経膠腫,
glioma)は全ての原発性脳腫瘍の30%余りを占める、最も頻度の高い原発性悪性脳腫瘍です。2016年5月に刊行されたWHO脳腫瘍分類(WHO
Classification of Tumours of the Central Nervous
System, revised 4th edition,
WHO2016)では、IDH変異と1p/19q
codeletionの有無に基づく分子診断が導入され、さらに2021年刊行の新しいWHO分類
(CNS5) では成人グリオーマはAstrocytoma, IDH-mutant;
Oligodendroglioma, IDH-mutant and
1p/19q-codeleted; Glioblastoma,
IDH-wildtypeの3型にまとめられました (Louis, Neuro Oncol
2021)。これはWHO2016の基準をさらに踏み込み、astrocytomaの診断にはIDH変異の確認が必要であること、IDH変異と1p/19q
codeletionの存在がoligdendrogliomaの診断の必要十分条件であること、glioblastomaは定義上IDH野生型であること、が明確にされました。WHO悪性度分類
(CNS WHO grade)
は各腫瘍型の中でそれぞれ定義されることになりました。特にastrocytomaでは新たにCNS
grade 4が導入されて、WHO2016でGlioblastoma,
IDH-mutatedと診断されていたIDH変異を持つglioblastomaはWHO
CNS5ではastrocytoma, CNS WHO grade
4と診断されます。Glioblastomaは従来遺伝子型に関わらず病理組織により診断されてきましたが、今後はIDH変異の検査によりIDH野生型であることを確認することが必要になり、形態学的にglioblastomaであってもIDH変異があればastrocytoma,
IDH-mutant, CNS WHO grade
4という診断になります。すなわち新しいWHO分類では分子診断を行うことが必須になります。
これらの分子分類を日常診療にリアルタイムに応用するためには、臨床検査としての分子診断法を確立する必要があります。当研究室では1p/19q
codeletionやIDH変異検出法、またastrocytoma grade
4の診断に必要なCDKN2A homozygous
deletionの検出法などの技術開発と企業への導出を通じて、分子診断の普遍化を目指しています。
また以前私たちの研究室では、テロメア伸長をもたらす逆転写酵素遺伝子であるTERTのプロモーター領域の点突然変異が成人の神経膠腫に極めて高頻度に認められることを発見しました(Arita,
Acta Neuropathol
2013)。点突然変異は2か所のhotspotにおいて相互排他的に見られ、いずれも新たな転写因子結合部位を生じさせることによりTERTの発現を亢進させます。TERTの点突然変異はIDH1変異と1p/19q
lossを持つoligodendrogliomaの大多数に見られるのに対し、IDH1変異を持つものの1p/19q
lossのない星細胞腫では極めてまれであること、さらにはIDH野生型の膠芽腫の多くではTERT変異が見られる腫瘍が多いことが分かりました(Arita,
Acta Neuropathol Commun
2020、図2)。これらの所見は、TERT変異が神経膠腫の発生機序に大きくかかわっているとともに、変異の有無に診断的価値があることを示しています。新しいWHO分類では、IDH野生型でびまん性星細胞腫の形態を持ち、EGFR増幅、染色体7番トリソミーと10番モノソミー、またはTERT変異がある腫瘍はglioblastoma,
IDH-wildtypeと診断されるようになりました。
これらにもとづき、IDH変異、1p/19q
codeletionにTERT変異を加えた分子分類を成人グリオーマの分子診断法として確立するために、大規模多施設共同研究を通して951例のグリオーマ検体を集めて検証を行いました。その結果、IDH変異、1p/19q
codeletion、TERT変異の組み合わせによりoligodendroglioma,
IDH-mutant and 1p/19q codeletedとastrocytoma,
IDH-mutantを予測できるだけでなく、glioblastoma, IDH
wildtypeのうちTERT変異を持つ最も予後不良な群を分類できることを示しました(Arita,
Acta Neuropathol 2016, 図2)。
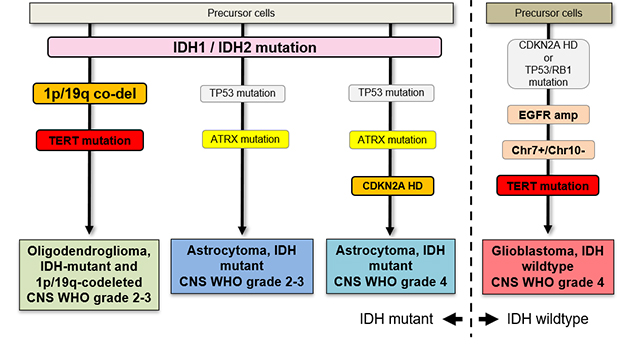
図4. WHO脳腫瘍分類(WHO CNS5)に基づく成人グリオーマ発生のモデル
|
臨床試験に伴う附随研究への応用に向けた、
分子腫瘍マーカーの研究とその検査法の標準化
|
現在、神経膠腫Glioblastomaの予後または治療反応性を予測することができるかまたは診断的価値を有すると考えられている代表的な分子的腫瘍マーカーには、MGMTのメチル化、1p/19qの欠失、IDH1/IDH2の点突然変異、BRAFの融合遺伝子などがあります。MGMTのメチル化を持つ膠芽腫の症例は持たないものより生存期間が長いことが認められており(予後因子)、また高齢者においては、temozolomide
(TMZ)はMGMTのメチル化を持つ膠芽腫にのみ奏効するという結果が欧米の第3相臨床試験で報告されました(治療効果予知因子)。こういった分子腫瘍マーカーの検査は日常診療及び臨床試験にほぼ必須の附随研究となっていますが、新しいWHO基準を踏まえて今後は臨床の場においてどのように運用していくかが大きな課題となっています。
しかし、これらの分子腫瘍マーカーに対する検査は様々な方法によって行われており、必ずしも標準的な検査法が定まっていません。当研究室ではPyrosequencing法によるメチル化のアッセイ法と判定基準を多施設共同研究により確立し、JCOG臨床試験等への応用を開始しています(図3)。同様に1p/19q
codeletionを正確かつ鋭敏に検出する新たなFISH法を開発し、成人グリオーマの分子分類検査法の標準化と保険収載を目指しています。
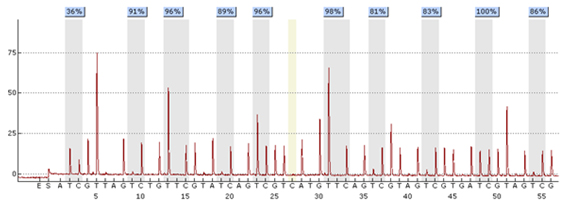
図5. Pyrosequencingによる10か所のCpGにおけるメチル化の測定
さらに当研究室では、中枢神経系悪性リンパ腫の患者さんの髄液から、リンパ腫に特異的な遺伝子変異であるMYD88
L265Pを高感度・高特異度に検出するデジタルPCRのアッセイを開発しました(Yamagishi,
Cancer Sci
2021)。髄液のリキッドバイオプシーによる中枢神経系悪性リンパ腫の診断が可能になれば、手術による生検なしで治療開始が可能になります。中枢神経系悪性リンパ腫のリキッドバイオプシーの標準化と保険収載を目指し、企業との共同研究を進めています。
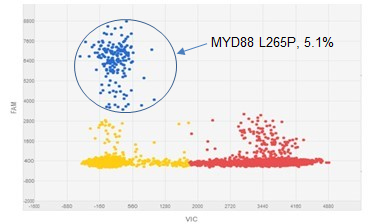
図6.
デジタルPCRによる中枢神経系悪性リンパ腫の髄液リキッドバイオプシーの結果(Yamagishi,
Cancer Sci 2021より)
|
TERTを標的とした膠芽腫に対する新規治療の開発
|
膠芽腫で高頻度に変異が見られるTERTはテロメラーゼの逆転写酵素サブユニットとして知られていますが、国立がん研究センター研究所増富らの研究により、TERTはRNA-dependent
RNA polymerase (RdRP) の機能も持つことが明らかにされ(Maida,
Nature
2009)、さらにTERTはそのRdRP活性により細胞周期の制御や幹細胞形質の維持に関与していることが示されました(Maida,
Mel Cell Biol
2014)。また増富らはドラッグスクリーニングによりエリブリンがTERT-RdRP活性の特異的阻害剤であることを報告しました(Yamaguchi,
PLoS One
2014)。これらの所見をもとに、エリブリンの膠芽腫に対する抗腫瘍効果を検証する非臨床試験を行ったところ、膠芽腫細胞についてエリブリンは極めて高い細胞増殖抑制効果を示しました。さらに膠芽腫細胞をマウスの脳内に移植して作成した脳腫瘍動物モデルにおいて、エリブリンは有意に生存延長効果を示しました。またエリブリンは正常脳にはほとんど移行しないものの、脳腫瘍には極めて高い濃度で移行するうえ、24時間以上も腫瘍組織内に高濃度に滞留することが示されました(Takahashi,
Cancer Sci
2019)。さらにエリブリンは放射線感受性増強効果を示し、エリブリンと放射線との併用によりエリブリンまたは放射線単独の治療に比べて脳腫瘍移植マウスの生存が有意に延長することが示されました(Miki,
Cancer Sci
2018)。これらの所見を受けて、エリブリンの再発膠芽腫に対する抗腫瘍効果を検証する医師主導治験が開始されています(AMED革新がん「TERTを標的とした新規阻害剤の悪性脳腫瘍に対する臨床応用を目指した研究」、代表:成田義孝・高橋雅道)。
さらにエリブリンは、TERT変異を持つ悪性髄膜種に対しても抗腫瘍効果を示すことが、動物モデルを用いた非臨床試験において示されました(図5、Nakano,
Cancer Sci
2021)。エリブリンはチュブリン合成阻害を起こさない低濃度でも悪性髄膜種細胞の増殖を抑制することから、エリブリンの抗腫瘍効果はチュブリン合成阻害以外の機序によることが示唆されました。
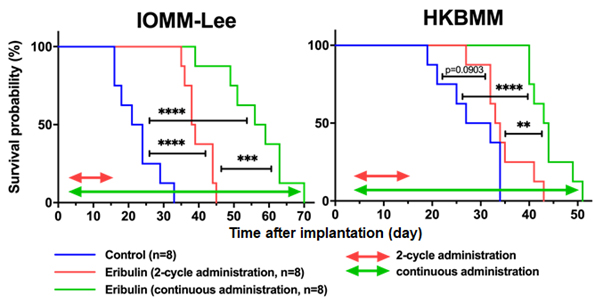
図7. エリブリンの悪性髄膜種移植脳腫瘍に対する抗腫瘍効果(Nakano, Cancer
Sci 2021より)
|
小児・AYA世代脳腫瘍の分子診断
|
脳腫瘍は小児に発生する固形がんの中で最も頻度が高く、国内では毎年約600例あまりが新規発症します(全国がん登録2016)。小児における悪性脳腫瘍は死亡率が高く、また小児脳腫瘍のサバイバーは治療後も再発や後遺症、高次機能障害などなどに生涯にわたって苦しめられることもあり、治療成績の向上が特に切望されている腫瘍です。AYA世代
(adolescence and young adult, 15-39歳)
にも中枢神経系胚細胞腫(上記)を始め脳腫瘍が高頻度に見られ、小児・AYA世代の脳腫瘍は一括して考えられるべき疾患になります。近年の分子遺伝学的探索により、小児脳腫瘍は成人脳腫瘍と全く異なる分子病態を持つことが明らかになりました。例えば小児のグリオーマではIDH変異は稀で、毛様細胞性星細胞腫(pilocytic
astrocytoma, grade
I)ではKIAA1549-BRAFの融合遺伝子やBRAFの点突然変異などによるMAPK経路の異常を80%以上に認めます。また小児の高悪性度グリオーマやDIPG
(Diffuse intrinsic pontine
glioma)ではヒストンH3.3(H3F3A)またはH3.1 (HIST1H3B)
の点突然変異を高頻度に認めます。髄芽腫においては分子所見にもとづいて世界的にコンセンサスの得られた4型分類が報告されており(Taylor,
Acta Neuropathol
2012)、上衣腫においても、テント上病変はC11orf95/ZFTA-RELA
fusionの有無による2型、テント下病変はメチル化プロファイルによりPFAおよびPFBの2型分類が提唱されています(Pajtler,
Acta Neuropathol
2016)。今後小児脳腫瘍の治療はこういった遺伝子解析に基づく分子診断をもとに、標的治療を含めた個別化医療が進められていくものと考えられます。当研究室では国際上衣腫コンセンサス会議に参加し、分子分類の国際的なコンセンサス形成に貢献しています。
こういった状況に対応するため、当研究室では、2016年から日本小児がん研究グループ(Japan
Children’s Cancer Group,
JCCG)において、全国から集められる小児脳腫瘍の中央診断を国立成育医療研究センター(データセンター)、群馬大学(中央病理診断)、大阪医療センター(髄芽腫分子診断)と分担して行っています(図6)。本システムにおいてはJCCG小児固形腫瘍観察研究のプロトコールに基づき、JCCG参加施設から臨床情報と手術検体をデータセンターに集め、群馬大学病理部にて中央病理診断を行った後、病理診断に基づいて髄芽腫を大阪医療センター、一部の胎児性脳腫瘍を群馬大学、グリオーマ・上衣腫・胚細胞腫およびその他の腫瘍を当研究室において分子分類を行っています。当研究室において解析に供されたJCCG中央診断の症例数は2022年8月現在までの約6年間で1,200例を超え、全国規模の小児脳腫瘍診断の一翼を担っています。中央診断の結果を用いた症例報告が、各施設から多数報告されています(Tsurubuchi,
Pediatr Blood Cancer 2019など)。
2022年からは、2021年に出版されたWHO脳腫瘍分類第5版(WHO
CNS5)の分子診断基準に準拠した遺伝子解析、特にゲノムワイドメチル化解析を診断確定に必要な症例に対して積極的に行っています。
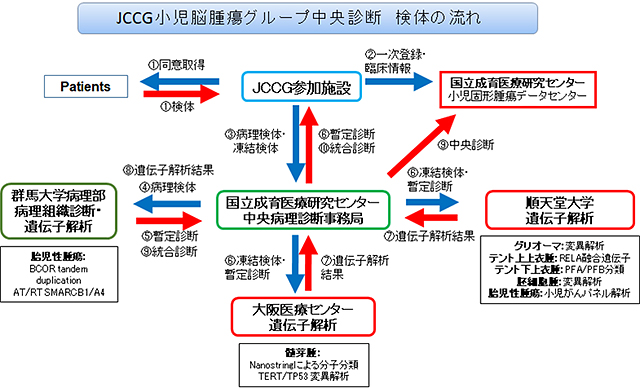
図8. JCCG小児脳腫瘍中央診断のフローチャート
以上のように、当研究室では多施設共同研究に基づき多数の検体で遺伝子異常と予後、治療反応性など臨床像との相関を調べ、治療方針の決定に役立つ分子診断を行って国内の小児脳腫瘍診療の均質化と向上に貢献していきたいと考えております。
|
|
|
|
|
|
