生体内のpH(酸性度)を一定に維持する「酸塩基平衡」は、生命を維持する上で極めて重要な役割を果たしています。酸塩基平衡の変化は、細胞機能に大きな影響を与えることが、これまでの研究でも示唆されてきました。順天堂大学大学院医学研究科細胞機能制御学の城(渡辺)愛理准教授(2025年1月取材当時)は、重炭酸イオンによる酸塩基平衡の変化が細胞応答を引き起こすメカニズムを発見しました。この研究成果は、脳梗塞などの新たな治療薬開発につながる可能性を秘めています。
「酸塩基平衡」の調節を担う重炭酸イオン

重炭酸イオン(HCO₃⁻)は、生体内のさまざまな組織や臓器における酸塩基平衡の調節に重要な役割を果たしています。重炭酸イオンとは、炭酸(H₂CO₃)から水素分子が1つ電離した状態の陰イオンのことを指します。酸塩基平衡は、体液のpH(酸性度)を一定に維持するための調節メカニズムと考えていただければいいでしょう。この酸塩基平衡を担うため、重炭酸イオンは「炭酸・重炭酸緩衝系」を構成しています。
酸塩基平衡による細胞の挙動の変化は、これまで主にプロトン(=水素イオン/H⁺)の濃度で規定されるpHの変化によって説明されてきました。pHやイオン濃度は、細胞機能に大きな影響を与える重要な環境要因で、前述の「炭酸・重炭酸緩衝系」をはじめとする複数の緩衝系によって、生体内環境はpH 7.4付近に一定に保たれています。これをpH恒常性と呼びます。
これまでの研究で、プロトンを感知するGタンパク質共役型受容体(GPCR)が複数見いだされ、プロトン濃度の上昇(pHの低下)が細胞応答を引き起こすことが明らかになっています。一方、近年重炭酸イオンや二酸化炭素も細胞応答を引き起こすことがわかり、これらを認識する受容体の存在が示唆されていました。
私たちの研究グループは、酸塩基平衡のメカニズムを解明する実験の過程で、GPCRのひとつである受容体GPR30がpH非依存的に重炭酸イオンによって細胞内カルシウムを上昇させることを発見しました。酸塩基平衡は、生命を維持する上で極めて重要な役割を果たしますが、その変化が細胞シグナル伝達にどう関与しているのかはまだ十分に解明されていません。私たちの研究は、この未知の領域に光を当てるものです。


重炭酸イオンによるGPR30の活性化は「偶然の発見」
私は、かねてよりGPCRの研究に携わってきました。GPCRは、細胞外からの信号を受け取り、それを細胞内に伝える重要な役割を果たす膜タンパク質で、これまでに300種類以上が報告されています。その中で注目したのがGPR30という受容体でした。もともとはエストロゲン受容体として研究されていたものですが、その機能については曖昧な点が多く、私はその正体を明らかにしようとしていました。
この研究が思わぬ方向へと進んでいくきっかけとなったのは、実験中の偶然の発見でした。当初、GPR30がエストロゲンや他のリガンド候補によって活性化されるかどうかを確認するための実験を行っていたのですが、使っていたバッファー(緩衝液)の瓶を実験中に割ってしまい、途中でバッファーがなくなってしまいました。そこでフェノールレッドフリーの培地で一部のリガンド候補を希釈しました。その結果、細胞が培地のみによって活性化されることを発見したのです。
培地による受容体の活性化の原因を突き止めるために、培地に含まれる成分を一つずつ添加して細胞の反応を観察しました。アミノ酸やグルコース、ビタミンでは受容体が活性化されなかったため、残りの要素として無機塩類の混合溶液を添加すると、細胞が活性化しました。そして、そこから一つずつ要素を除いていくことで、最終的に、重炭酸イオンがGPR30の活性化を引き起こしていることを突き止めたのです。これは、GPCRがプロトンによって活性化されるのとは異なる、新しいシグナル伝達メカニズムを発見するものでした。

「酸塩基平衡の変化が細胞応答を引き起こす」という新たな概念の誕生
GPCRは、これまでホルモンや神経伝達物質などの特定のリガンド(結合する分子)によって活性化されると考えられていました。しかし、私たちの研究によって、重炭酸イオンという従来環境因子と考えられてきたものもまた、GPCRを活性化することがわかったのです。これは「酸塩基平衡の変化がGPCRの活性化を介して細胞応答を引き起こす」という新しい概念の創出を示唆するものでした。
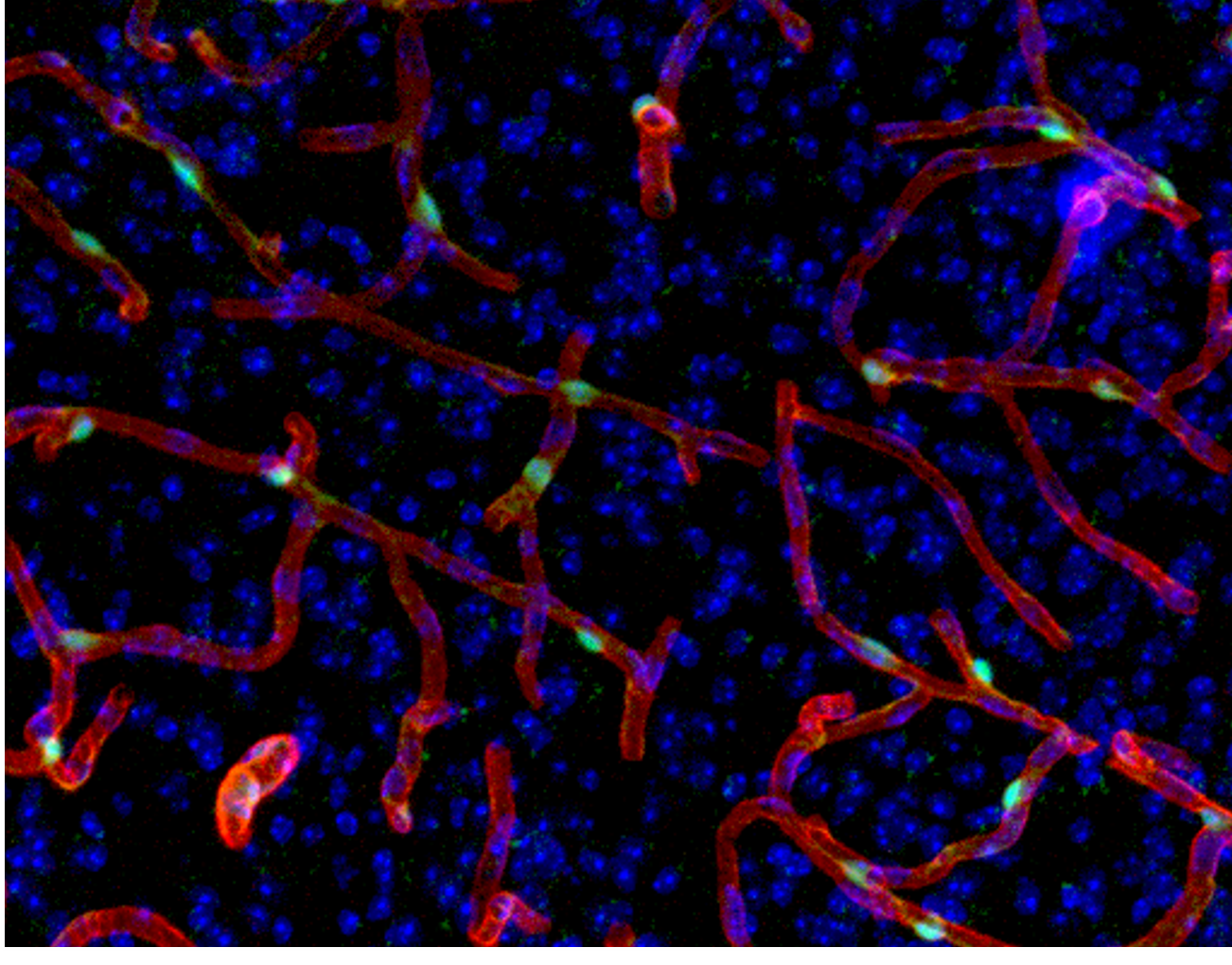
また、GPR30は脳の微小血管壁細胞(ペリサイト)に発現しており、血流の調節に関与していることが明らかになりました。この発見により、GPR30が虚血再灌流障害に関与している可能性も出てきました。
通常、脳梗塞の治療では血流を再開させることが重要視されますが、虚血によって弱った神経細胞は、血流の再開によってかえって損傷を受けることがあります。また再開通後の血管の炎症や酸化ストレスによって神経細胞がダメージを受けることも知られています。一早い血流の再開によって虚血から神経細胞を救うことが脳梗塞からの回復を促進すると考えられ、GPR30がこのプロセスを調節することで、脳梗塞の新たな治療ターゲットとなる可能性も出てきたのです。
私たちは、GPR30が脳梗塞の病態に関与しているかどうかを調べるために、遺伝子操作によってGPR30を欠損させたノックアウトマウスを作成し、脳梗塞モデルを用いた実験を行いました。その結果、GPR30を欠損したマウスでは、通常のマウスに比べて脳梗塞後のダメージが軽減されることが明らかになりました。これは、GPR30が虚血再灌流障害の悪化に関与していることを示唆する重要な結果だといえます。
脳梗塞の治療においては、急性期の虚血再灌流障害を軽減することは極めて重要です。重炭酸イオンに着目して、脳の虚血再灌流障害の機序を明らかにすることで脳梗塞の画期的な治療が開発できるかもしれません。

新たな研究領域「重炭酸イオン生物学」を創生する

私たちは現在、GPR30の活性を制御する薬剤の開発を進めています。2024年に発表した論文の中では、GPR30欠損マウスで脳梗塞モデルを作成すると、野生型マウスに比べて脳虚血再灌流障害が軽くなるという結果を出しています。この結果は、GPR30の活性化を阻害する薬が脳梗塞の治療薬になる可能性を示唆するものです。研究室では、すでに培養細胞を用いたスクリーニングを行い、GPR30の活性を調節する化合物の探索を進めています。今後は、マウスモデルでの効果を検証し、将来的には脳梗塞やその他の疾患の治療薬としての実用化を目指したいと考えています。
この研究は、脳梗塞の治療だけでなく他の疾患にも応用できる可能性を秘めています。例えば、腎不全や呼吸不全などの病態では、重炭酸イオンの濃度が大きく関与していることが知られています。腎臓は酸を排泄するとともに重炭酸イオンを再吸収し、肺はCO₂を排出することで酸塩基平衡を維持しています。したがって、GPR30がこれらの臓器でどのような役割を果たしているのかを調べることで、新たな治療法の開発につながるかもしれません。
今回の研究は、実験中の偶然の出来事から始まり、「酸塩基平衡による細胞内シグナル伝達の調整」という新しい概念を創出することにつながりました。私の目標は、新たな研究領域「重炭酸イオン生物学」を創生することです。酸塩基平衡とGPCRの関係をより深く理解し、医学や生物学の新たな可能性を切り拓いていきたいと考えています。

研究者Profile

城(渡辺) 愛理
Airi Jo-Watanabe
慶應義塾大学医学部 坂口光洋記念 生体内イオン応答学講座 准教授
順天堂大学大学院医学研究科細胞機能制御学 非常勤講師
Researchmap