
双極性障害の病態を明らかにして精神疾患の診断・治療に革新をもたらす
医学部精神医学講座では、精神疾患の一つである双極性障害の病態解明に向けて、「ミトコンドリア障害仮説」にもとづいた研究を推進しています。この研究により分子レベルでの病態が解明されれば、これまで心の病気とされてきた精神疾患の診断や治療がガラリと変わる可能性があります。このように、まったく新しい視点から研究に取り組む加藤忠史教授、西岡将基准教授、窪田美恵特任准教授による座談会を通じて、精神医学の現在と未来を読み解いていきます。
双極性障害の脳内で起きている
生物学的変化を明らかにしたい
――精神疾患の中でも双極性障害を研究テーマとしているのはなぜですか。
加藤 精神医学講座としては、統合失調症、気分障害、ストレス関連障害、睡眠障害、認知症、発達障害などの幅広い精神疾患に対応していますが、個人的には双極性障害の病態を解明して、よりよい診断や治療につなげたいというモチベーションで研究を進めています。
双極性障害は、統合失調症と並んで「二大精神疾患」と呼ばれていて、精神疾患の中でも頻度が高い病気です。しかし、ほかの精神疾患に比べて病態解明などの研究が遅れている印象があります。その理由として、患者さんのデータが不足しているため、ゲノム解析が進んでいないということが挙げられます。特に、脳内の神経回路についての研究はほとんど行われていません。
――なぜ双極性障害の研究が進まなかったのでしょうか。
加藤 私自身、研修医になって初めて双極性障害の患者さんを診たときに、動けないほどのひどいうつ状態にあった人が翌日には躁状態になっていることに驚き、これは脳の変化が影響しているのに違いないと感じました。それならば研究を進めていくことで必ず原因を解明できるという確信を持って研究を始めました。しかし、実際にはそんなに簡単なことではありませんでした。昨日のうつ状態の患者さんの脳と、同じ患者さんの今日の躁状態の脳をオミックス解析で比較したら、たちどころに原因がわかるかも知れませんが、実際には、患者さんの脳の分子・細胞レベルの解析を行うことは、倫理的・技術的に困難だからです。この病気の原因に関する有力な手がかりが得られたことから、次のステップに進み始めたところです。

左から:窪田美恵 特任准教授、西岡将基 准教授、加藤忠史 教授
――特に注力しているのはどのようなことですか。
加藤 私たちは、双極性障害の患者さんの脳内で細胞内のカルシウム制御に関わるミトコンドリアの機能障害があることを示すデータを得たことをきっかけに、2000年からミトコンドリア障害仮説を提唱してきました。その仮説にもとづいて、モデルマウスの作製、亡くなった患者さんの脳組織を使った解析、ゲノム解析など行っています。
窪田 私はモデルマウスや死後脳を用いて、ミトコンドリア機能障害が発生している脳の部位を調べる研究をしてきました。ミトコンドリアはエネルギー産生の場として有名ですが、脳、特に神経細胞間のシグナル伝達を担うシナプスにおいては、カルシウム濃度の制御という重要な役割を担っています。カルシウム濃度とシナプスからの神経伝達物質の放出効率は相関しており、カルシウム濃度が上昇したときにはミトコンドリアが素早くカルシウムを取り込んで、グルタミン酸やセロトニンなどの神経伝達物質の放出量を整えるのですが、ミトコンドリアがうまく働かないとカルシウム制御ができず、神経伝達に影響が出ると考えています。そこで、ミトコンドリアのカルシウム制御能を亢進させるような化合物をスクリーニングする研究にも取り組んでいます。
西岡 私は、ゲノム解析とシングルセル解析という二本柱で研究を展開しています。特に注力しているのが、脳の病態を網羅的に見られるようになったシングルセル解析です。例えると、真っ暗で見えなかった深海の様子が潜水艦によって見えるようになるほどの劇的な変化で、細胞ごとの性質がわかることで、多くのことが明らかになると期待しています。
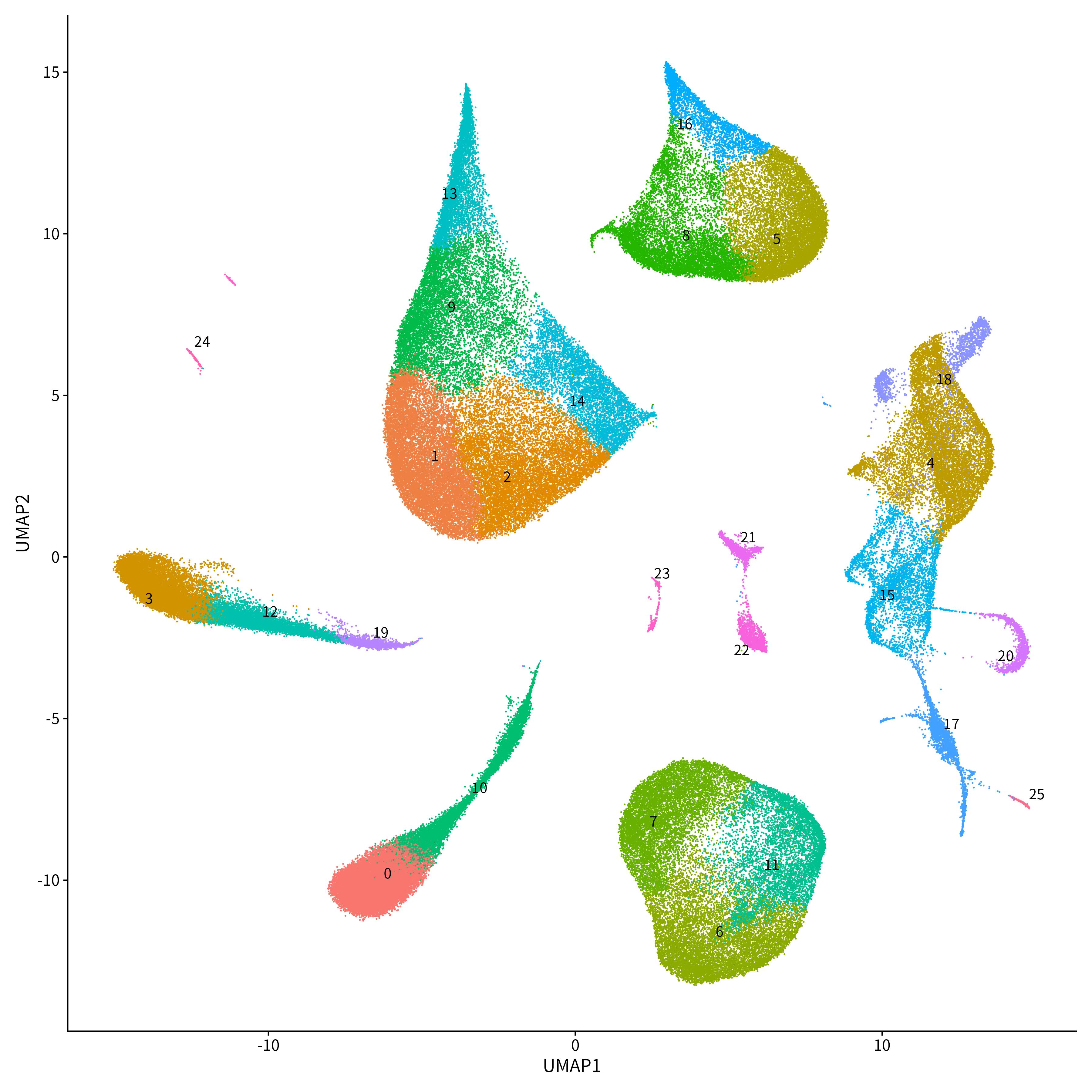

【左図】視床41サンプルの単一核RNAシーケンスデータを統合・クラスタリングし、UMAPにて図示した。合計25セルクラスターに分類され、このうちクラスター15がPVT神経に相当する。
ミトコンドリア異常の発見をきっかけに
視床室傍核という原因部位に辿り着く

――これまでの研究成果の中でブレイクスルーのきっかけとなったものはありますか。
加藤 双極性障害の原因を解明しようと研究を進める中で、ミトコンドリア病の中枢神経症状として双極性障害があらわれる場合があることに着目して、そのモデル動物を作製しました。私たちが作ったモデルマウスは、反復性うつ状態が見られることに加えて、抗うつ剤の投与により躁状態に近い変化を示すことがわかました。それまで存在しなかった双極性障害のモデル動物を作製できたことで原因脳部位を探索することが可能になり、その結果、視床室傍核にミトコンドリア異常が蓄積していることを見出しました。さらに視床室傍核の神経回路操作が反復性うつ状態を引き起こすことがわかるなど、その後の研究を大きく前進させるきっかけとなっています。
――そこから視床室傍核に注目するようになったのですね。
加藤 双極性障害研究において脳部位を探索しているグループは、私たちのほかにはほとんどありません。ほかのグループの研究は、網羅的なゲノム解析や大規模なMRI測定を何千名の患者さんで行うことでわずかな差を見つけようというやり方です。対して、私たちの視床室傍核の研究で得られた結果は、何千人までサンプル数を増やさないとわからないというものではなく、もっと病気の本質に近い研究だと考えています。
しかし、私たちがこの仮説がかなり有力だと思っていても、周囲はそのような視点で精神疾患を捉えていません。そういう人たちを納得させられるかどうかが一番の課題です。
西岡 その点は本当に難しいですね。サイエンスの世界では統計的有意性を示すことも必要なので、認められるためのサンプルサイズを検討することも大切だと思っています。しかも、私たちがターゲットとしている視床という脳部位は、死後脳でも入手しにくい位置にあり、サンプル数が増やせないという難しさがあります。皮質のように比較的入手しやすい部位であれば、ロバスト(頑健性)な結果を得られるのですが、視床はそれが難しい領域です。

窪田 脳試料が入手できるかどうかは、本当に重要です。私たちの場合は、ありがたいことにカナダのブレインバンクが、双極性障害の貴重な死後脳の視床を、ある程度大きなブロックで提供してくれています。そのお陰で視床室傍核を含む広い範囲での解析をすることができたので、ミトコンドリア機能障害を示す結果が得られました。今後、日本のブレインバンクから入手した日本人サンプルについてもミトコンドリア障害を検証することができれば、双極性障害の原因の一つとして有力な候補になりえると思います。
独自のアプローチだからこそ
誰もが納得するデータが必要になる
――これからは臨床を見据えた研究を進めるとのことですが、具体的にはどんなことをするのでしょうか。
加藤 私たちのデータは、視床室傍核が双極性障害の原因部位であることを強く示唆すると考えています。これからはその科学的根拠やデータを世の中に示して、私たちの説に対して懐疑的な人たちも納得させていかなければいけません。

西岡 本当ですね。まったく病態が明らかになっていない双極性障害について、ほかの研究グループとは大きく異なる視点で行った研究だと捉えています。そのため既存のデータもありませんから、説得力のあるデータを出すにはかなり高いハードルを越えなければいけません。どこまでデータを揃えれば納得させられるかというのは難しい問題ですが、信頼性の高いデータを揃えられるよう進めています。
さらに先の将来については、この研究をどのようにして臨床に還元するかを考えています。視床室傍核のミトコンドリア機能障害はすべての双極性障害の患者さんに共通した原因ではなく、複数ある双極性障害のタイプの一つかもしれません。現在はそのような分類もできていない状況にあるので、私たちの研究をきっかけにタイプ分類ができれば、タイプごとに最適な治療につなげられます。タイプによっては、別の疾患のために開発された既存薬が効く可能性もあります。もちろん、効果的な新しい化合物が見つかれば、ターゲットを狙い撃ちするようなより良い薬を開発できるはずです。
窪田 今、私が進めている研究の一つが、そのような化合物のスクリーニングです。向精神薬の中には、ミトコンドリアのカルシウム取り込みという機能に作用するものもあるのですが、今まで調べられていなかったせいで、知られていません。他の疾患を対象として開発されたけれど、市販されるまでには至らなかった薬でも、実はミトコンドリアにも機能する薬があれば使えるかもしれません。そこで、脳ミトコンドリアを用いてスクリーニングするという新しい方法で、新規気分安定薬を探索することを一つのテーマとしています。


ゲノムにもとづく個別化医療を実現
精神医学にパラダイムシフトを起こす
――順天堂大学に研究室を構えて良かったことはありますか。
西岡 これまでのゲノム解析の結果を、多くの患者さんのデータで検証できることが大きいですね。それは理化学研究所ではできないことでした。
窪田 我々のチームでは、現在、ミトコンドリアDNA変異を持つ患者さんの細胞から作製したiPS細胞を使って、スクリーニングした化合物の効果を検証使用という取り組みを始めています。そのように順天堂大学では、患者さんの検体が入手できるというメリットだけでなく、我々の取り組みを成功させるため、ゲノム・再生医療センターに協力してもらってiPS細胞の作製に関する技術トレーニングを受けているところです。まだ始めたばかりですが、オルガノイドと呼ばれるミニチュア臓器を培養できるようになれば、これまで以上に多くの発見があるのではないかと思っています。
――研究室としての今後の目標を教えてください。
加藤 あと5年くらいの間に、双極性障害の原因部位が視床室傍核だと言い切れるようになることと、視床室傍核のミトコンドリア機能障害という病態を検査で検出できるようにすることという目標を掲げています。並行して創薬研究も進めていますから、患者さんごとの病態に即した個別化治療につなげることが最終的な目標です。現在の医療では、がん治療に代表されるように、ゲノム診断に応じた分子標的薬治療が当たり前に行われています。そういった治療に比べて、精神医学は10年も20年も遅れているといわざるを得ない状況にありますが、私たちの研究がその第一歩を踏み出せるよう、西岡先生、窪田先生とともに研究を進めていきます。
――そうなれば精神医学は大きく変わることになりますね。
加藤 現在の精神医学では、会話を主とした診察をゴールデンスタンダードとして、症状による分類に従って診断して、薬を処方しています。それは精神疾患を心の病気だと捉えたやり方です。しかし、精神疾患は脳の病気であるという認識が広がり、脳の病態が解明されていけば、将来的には精神疾患についても細胞レベル、ゲノム解析にもとづく分子レベルの病態に基づいて分類しなおすことになるでしょう。そこまで辿り着くのはまだまだ先のことになると思いますが、いずれは精神医学に大きなパラダイムシフトが起きると信じています。

研究者Profile

加藤 忠史
Tadafumi Kato
医学部精神医学講座/大学院医学研究科精神・行動科学
教授
【関連記事】ミトコンドリアの異常に着目し双極性障害の病態解明に迫る
【関連記事】双極性障害の病態を明らかにして精神疾患の診断・治療に革新をもたらす
Researchmap
研究者Profile

西岡 将基
Masaki Nishioka
医学部精神医学講座
准教授
Researchmap
研究者Profile

窪田(坂下) 美恵
Mie Kubota-Sakashita
大学院医学研究科気分障害分子病態学講座/医学部精神医学講座
特任准教授
Researchmap




