研究内容(研究者向け) → 一般の方はこちら をどうぞ
をどうぞ
当施設では、通常業務に加えて、以下のような基礎研究も行っています。
(1)新規がん遺伝子の探索
幹細胞は、複数の細胞に分化できる多能性を持ち、未分化な状態においては自己複製(多能性を維持したまま増殖すること)を行う細胞であり、自己複製と分化の繰り返しにより体内の組織や臓器を作り出す役割を担っています。がん組織においても幹細胞のような性質を持つ細胞(「がん幹細胞」と呼ばれます)が存在していて、がんの発生ではこのがん幹細胞が自己複製と分化を繰り返して様々ながん細胞を含んだがん組織を作り出していると考えられています。
がんの治療において大きな問題となる再発や転移は、抗がん剤や外科的手術によってがん組織に存在する大半の細胞を取り除いても、がん幹細胞ががん組織内に少数でも残存してしまうと、再び自己複製を行って足場非依存的に増殖してしまうことが原因であると考えられています。そのため、がん幹細胞の自己複製維持に関与している遺伝子を同定して自己複製を抑制する方法を見出せば、がん幹細胞による再発や転移を抑制できるという研究アプローチが考えられます。
ところが、絶対数の少ないがん幹細胞の単離が難しいことに加え、がん幹細胞の持つ多様性の問題(染色体が不安定であるために自己複製維持とは関係のない遺伝子にも変異が入っていること)もあり、がん幹細胞の自己複製維持に関与している遺伝子の同定は進んでいません。これまでのがん研究においては、がんを多発する家系から原因遺伝子を同定、またはがん細胞からがん化を誘導する遺伝子を単離する等のアプローチがなされてきました。その結果、数々のがん遺伝子が発見されましたが、がん細胞の多様性、つまりがん患者個別の変異が生じていることが、このアプローチによるがん遺伝子同定の障害となってきました。
このような現状を打破するために、私たちは胚性幹細胞(ES細胞)とがん幹細胞の間に見られる高い類似性に着目しました(図1)。両細胞は、マウスに移植すると自己複製を行って腫瘍を形成すること、高いテロメラーゼを持つこと、半永久的に増殖が可能であることといったように、多くの共通の特徴を持っています。
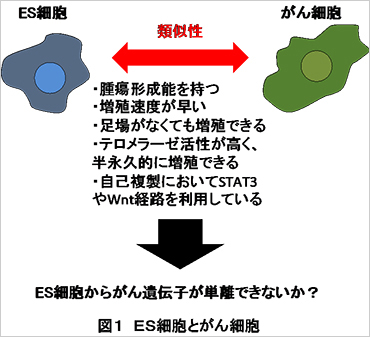
また分子レベルで比較しても、がん細胞の増殖に関与している分子であるSTAT3やMycがES細胞の自己複製において重要な役割を担っていることや、ES細胞の自己複製に関与しているOct3/4やSox2ががん細胞の増殖に関与していることも報告されています(Koide , 2014)。実際、私たちもがん細胞の発生や増殖に深く関わっているβ-cateninやEtv4/5が、ES細胞の自己複製を制御するということを見出しています(Takao
et al., 2007; Kelly
et al., 2011; Akagi
et al., 2015)。
このような類似性に加えて、ES細胞は遺伝子の安定性が高いこと、また多様性が少ないという特徴を持つことに着目し、私たちはES細胞が自己複製維持遺伝子の単離に適している材料と考えて、ES細胞に発現している遺伝子の中からがん遺伝子を探しています。その結果、実際にES細胞に発現しているZfp57と呼ばれる転写因子を新規のがん遺伝子として同定することに成功しました(Tada
et al., 2015)(図2)。さらに、このZfp57が大腸癌の転移にも関与していることを見出しました(Shoji
et al., 2019)。またZfp57の発現が、Zfp57と同様にES細胞に発現している遺伝子であるNanogによって制御されていることも見出しています(Yamaguchi
et al., 2014; Shoji
et al., 2019)。
現在はZfp57による細胞がん化の分子機構の解析とともに、ES細胞に発現している新たながん遺伝子の探索を行っています。最近、Zfp296という転写因子を新しいがん遺伝子の候補分子として見い出しています。
(2)ES細胞の増殖促進因子の探索
ES細胞やiPS細胞を再生医療に利用するためには、これらの多能性幹細胞を効率良く増殖させて、治療に必要な量を手に入れることが必要です。これまでの研究からES細胞の増殖を促進する因子としてACTH(副腎皮質刺激ホルモン)やShh(ソニックヘッジホッグ)、アクチビンといった分子が見出されています。
私たちはES細胞とがん幹細胞の類似性を利用して、ES細胞の増殖促進因子の単離も試みています。具体的には、がん細胞の増殖因子として働く因子の中にES細胞の増殖促進因子 が存在する可能性を検討しています。その結果、最近PDGF-Cと呼ばれる分子がES細胞の増殖促進因子として働くことを見出しました(Kinjo
et al., 2018)(図3)。
現在はPDGF-CによるES細胞の増殖促進の分子機構の解析とともに、新たな増殖促進因子の探索を行っています。
(3) mdxマウス腫瘍のメタボロミクス解析
ジストロフィン遺伝子(DMD)は、遺伝性の進行性骨格筋消耗性難病であるデュシェンヌ型筋ジストロフィー(DMD)の原因となる巨大遺伝子です。近年、骨格筋前駆細胞から発生する腫瘍(肉腫)でDMD遺伝子内変異が検出されたことから、この遺伝子は腫瘍抑制・抗転移因子として認識されるようになりました。現在、ジストロフィンの遺伝子や転写産物の解読に焦点を当てた2つのプロジェクトが進行中です。
1つ目のプロジェクトは、デュシェンヌ型筋ジストロフィー(DMD)モデルマウス(mdx)の腫瘍における親水性メタボロームプロファイルを調査するプロジェクトです。mdxマウスでは腫瘍が自然発生することが報告されています(図4)。また、私たちはDMD患者においても様々な腫瘍が自然発生していることを確認しています(Niba et al., 2020)。しかし、そのメカニズムは明らかではありません。さらに、ジストロフィー系での腫瘍増殖に寄与する代謝物も明確に確立されていません。そこで私たちは6匹のmdxマウスを作製し、約17~22週後に様々な腫瘍が自然に発生するかどうかを観察しました。そのうちの1匹のメタボロームプロファイルを解析したところ、骨格筋との差異が認められました(図5)。本研究では、これらの腫瘍の自然増殖やオートファジーによる浸潤、上皮間葉転換に寄与すると考えられる親水性代謝物を同定し、新規がん治療への応用を目指します。
現在、腫瘍の自然増殖に寄与する代謝物について研究しています。
現在、私たちは主要な代謝産物と腫瘍の増殖や浸潤との関連性を解明しようとしています。
(4) 選択的スプライシングとアンチセンスオリゴヌクレオチドによる調節
横紋筋肉腫(RMS)は、骨格筋前駆細胞から発生する世界で最も一般的な小児がんです。デュシェンヌ型筋ジストロフィー関連遺伝子であるジストロフィンの機能不全は、RMSの腫瘍の成長と転移に関与しており、それゆえRMSの腫瘍抑制因子および抗転移因子であると考えられています。私たちは、ジストロフィン遺伝子のプレmRNAスプライシングにおけるイントロンリテンション(IR)がジストロフィン分子の機能不全につながり、RMSの腫瘍抑制を促進する因子や薬剤を減少させている可能性があることから、このスプライシング機構を研究することによって分子標的治療法の開発を目指しています(Niba et al., 2017, Kawaguchi and Niba et al., 2018)(図6)。
アンチセンスオリゴがジストロフィンの機能を回復させるメカニズムについて、Ca2+などのシグナル伝達分子の関与も含めて解析中です。
