パーキンソン病の研究における世界的トップランナーである、順天堂大学大学院医学研究科神経学講座の服部信孝主任教授。parkin、CHCHD2、PSAP/Prosaposinといった3つのパーキンソン病の原因遺伝子を同定したほか、パーキンソン病の研究、診断・治療法を革新してきた実績をもち、その業績は文部科学大臣賞、デビッドマースデンレクチャーアワード、武田医学賞など幾多の受賞によって評価されています。その服部主任教授を中心とした研究グループが新たに、パーキンソン病や認知症の原因となる異常構造タンパク質を血液検査で検出することに成功。パーキンソン病等のα-シヌクレイノパチーの病態解明や新規治療法開発につながる成果として、本論文はNature Medicine誌のオンライン版で公開されました。
α-シヌクレイン伝播の機序解明を起点として

今回の研究成果では、患者さんの血清(血液)からパーキンソン病、レヴィ小体型認知症、多系統萎縮症などα-シヌクレイノパチーと呼ばれる疾患群の原因となる、異常α-シヌクレインシードの検出を実現しました。身体的な負担が少ない血液検査でα-シヌクレイノパチーの早期リスク診断が可能になり、今後臨床現場での認知症診断は大きく変わっていくでしょう。
血液、尿、唾液などから病原を解析するリキッドバイオプシーによって、パーキンソン病や認知症の原因タンパク質を検出する研究を推進しはじめたのは2010年代から。それまでは原因遺伝子の特定など、病態解明を主軸においていましたが、2014年に「パーキンソン病の代謝産物バイオマーカー創出およびその分子標的機構に基づく創薬シーズ同定」という研究が日本医療研究開発機構のAMED-CRESTに採択されたことにより、病態解明と並行してバイオマーカーの研究が大きく進展しました。
「レヴイ小体構成蛋白α-シヌクレインの伝播・凝集機序解明と革新的進行阻止療法の開発」と題した今回の研究は、基盤研究(S)として科研費に採択されており、研究グループは我々順天堂に加えて、長崎大学大学院の松本弦博士やルクセンブルグ大学のReijo Krüger教授などで構成されています。α-シヌクレイノパチーでは脳及び全身にα-シヌクレインというタンパク質の凝集体が出現し、神経細胞死が引き起こされることで、ふるえやこわばり、動きが鈍くなるといった症状があらわれます。この全身の末端神経にα-シヌクレインが蓄積する過程において、「全身への病気の広がりに血液を介した経路が関与している可能性がある」という仮説から研究はスタートしました。


バイオマーカーの有用性を世界で初めて証明
前述の仮説をもとに、研究では患者さんの血清からα-シヌクレインを凝集させる原因となる、病的な構造をもつ異常α-シヌクレインシードの検出に成功しました。そこで血清から異常α-シヌクレインシードを抽出する手法として、新たに開発したのがIP/RT-QuIC法です。
IP/RT-QuIC法は特定のタンパク質などを抗原として認識する抗体を使って、標的となる抗原や抗原に親和性を示すタンパク質などを選択的に分離する免疫沈降法(IP)と、タンパク質を増幅させるreal-time quaking-induced conversion(RT-QuIC)法を組み合わせた手法です。これにより血清中の極微量のα-シヌクレインシードであっても検出が可能となりました。
IP/RT-QuIC法を開発した後、私達はα-シヌクレイノパチー患者、非α-シヌクレイノパチー患者、神経変性疾患ではない健常者、parkin遺伝子に変異のある家族性パーキンソン病(PARK2)患者、前駆期α-シヌクレイノパチーであるレム睡眠行動異常症患者の血清をサンプルとしてIP/RT-QuIC法によるスクリーニングを実施しました。結果としてα-シヌクレイノパチーであるパーキンソン病で95%、レヴィ小体型認知症で90%、多系統萎縮症で64%、またレム睡眠行動異常症では44%の患者さんからα-シヌクレインシードを検出しました。一方で非α-シヌクレイノパチー全体では9%、対照では8.5%、PARK2患者では0%の検出率となり、α-シヌクレイノパチーでのα-シヌクレインシードの検出が有意に高い結果となりました。
また、患者血清由来のα-シヌクレインシードを野生型マウスの線条体に投与したところ、パーキンソン病患者由来のα-シヌクレインシードを投与した場合、投与後3ヶ月から1年後にかけて徐々に病理的に異常なリン酸化α-シヌクレインの凝集体が確認できるなど、患者血清由来のα-シヌクレインシードがα-シヌクレイノパチーの病態を形成する性質を有していることが示唆されました。これらの成果は、α-シヌクレインシードがシヌクレイノパチーの診断と鑑別のバイオマーカーとして有用であることを、世界で初めて明らかにしたものです。

疾患ごとに凝集体の構造が異なることを発見
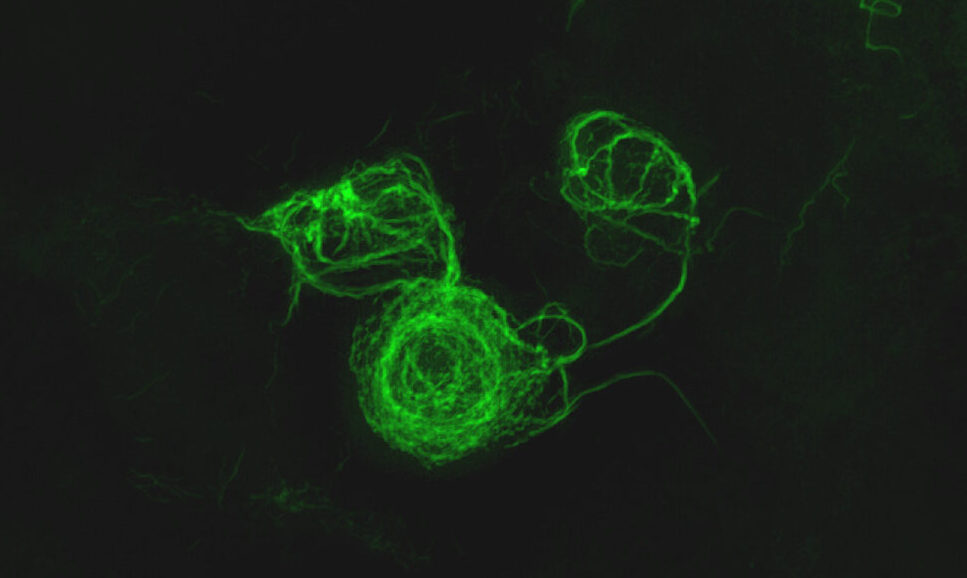
研究では、疾患ごとにα-シヌクレイン凝集体の構造が異なることも発見しています。IP/RT-QuIC法で増幅したα-シヌクレイン凝集体を確認したところ、パーキンソン病では2本の細い線維がねじれた構造が、レヴィ小体型認知症では数本の線維が複雑にねじれた構造が、また多系統萎縮症では太い線維がねじれる、または直線的な構造が明らかになり、疾患によって構造が異なることが判明。この発見は、血液検査で検出したα-シヌクレイン凝集体の構造を検査することで、α-シヌクレイノパチー群の中から詳細な疾患を診断する手法への発展が見込まれるもの。さらに疾患ごとに凝集体の構造が異なる理由を解明することで、病態解明や疾患修飾療法開発への端緒も期待できるでしょう。
α-シヌクレインの異常凝集と伝播がはじめて注目されたのは1990年代後半のこと。以降、標的とした研究が世界的に進められてきたものの、診断法や治療法への社会実装は十分といえるレベルには至っていません。血清からの異常α-シヌクレインシードの検出手法の開発と、α-シヌクレイン凝集体の構造解析による疾患診断の可能性を明らかにした今回の成果は、そういった現状にブレイクスルーをもたらすものとなるでしょう。研究は血液診断の精度を高めていくだけでなく、凝集や分解に関与する細胞内因子や遺伝子産物の解析にともなう基礎メカニズムの解明、その先にある治療法の開発へと進んでいます。

早期リスク診断技術を2030年までに実装する

血液診断の手法として新たに開発したIP/RT-QuIC法の強みは、これまでのクライオ電子顕微鏡を用いた検査などに比べて、汎用性が高い点にあります。どんな技術であれ、最終的に臨床現場で採用できる、社会実装できる技術につなげることが、いまでも臨床現場に立ち続ける私が目指している研究の大命題です。IP/RT-QuIC法も当初は難易度が高く臨床応用へのハードルがありましたが、簡易化が進み、現在では多くの医療機関や検査機関で実施可能なレベルまで落とし込めています。
たとえばレム睡眠行動異常症、便秘、嗅覚低下など、パーキンソン病などとの関連が疑われる兆候があらわれた患者さんに対して血液検査を行い、疾患の早期発見につなげる。2030年までには保険収載とともに、そのような検査環境を臨床現場に整備できるでしょう。並行して進めるパーキンソン病やレヴィ小体型認知症の進行を阻止する治療法についても、α-シヌクレインの蓄積を抑制する血漿交換療法や抗体の開発を進めており、着実な成果が得られています。
血液検査による早期診断と予防的治療法が確立することで、従来、対処療法しか手立てがなかったパーキンソン病や認知症の診断・治療を取り巻く環境は大きく変わります。医療費削減や介護負担の軽減などを通して、患者さんやそのご家族のQOL向上にもつながるでしょう。目標はパーキンソン病や認知症を「未病の状態で発見し、未病のまま収束できる」疾患にすること。今後さらにタウ、アミロイドβ、TDP-43といったα-シヌクレイン以外の疾患関連タンパク質を検出できる血液診断技術の開発も目指しており、神経変性疾患の診断・治療環境のより一層の進化を叶えたいと考えています。

研究者Profile

服部 信孝
Nobutaka Hattori
大学院医学研究科 神経学
教授
【関連記事】世界トップクラスのパーキンソン病iPS細胞バンクを背景に根本的治療薬の開発を目指す!
【関連記事】「エクソソーム」の機能を解明し脳梗塞の新たな治療法を確立する
【関連記事】世界有数の神経学講座が進める隠れ脳梗塞への画期的アプローチとは
Researchmap




