1,000人に1~1.5人が発症するパーキンソン病は、60歳を過ぎると約100人に1人の患者さんがいるといわれ、社会の高齢化が進むとともに身近な病気となっています。順天堂大学大学院医学研究科ゲノム・再生医療センターの赤松和土教授の研究グループはiPS細胞を活用し、パーキンソン病の根本的な治療薬を発見するための研究を続けています。
パーキンソン病の治療薬開発にiPS細胞を活用する理由とは

パーキンソン病は、中脳にあるドーパミン神経細胞が減少してドーパミンの量が減ることにより発症し、手が震えたり、体が動きにくくなったり、逆に体が意思に反して動き出すなどの症状がある病気です。現在の医療では不足しているドーパミンを補充する治療が主流となっていますが、病気の進行そのものを食い止めることはできません。そこで私たちは根本的な治療薬を開発するためにiPS細胞を活用した研究を進めています。 iPS細胞とは神経細胞や肝臓、心臓、筋肉など他の細胞に分化する能力を持つ細胞です。iPS細胞は人の体内から採取した細胞に複数の遺伝子を導入して作られた細胞で、2006年に京都大学の山中伸弥教授が発表され、2012年のノーベル医学・生理学賞を受賞されたことが広く知られています。 パーキンソン病は非常に長い時間をかけて脳内のドーパミン神経細胞が減っていく病気ですが、その研究では実際に患者さんの脳の中で何が起きているのかを直接見ることは難しいという制約があります。しかし、iPS細胞を利用すれば、患者さんの脳内の細胞と同じような現象を実験室の中で再現することができます。すなわち、病気の原因を正確に理解して新しい治療法を探すことができると期待されます。
血液由来のiPS細胞を効率よく神経細胞へ分化する方法を開発
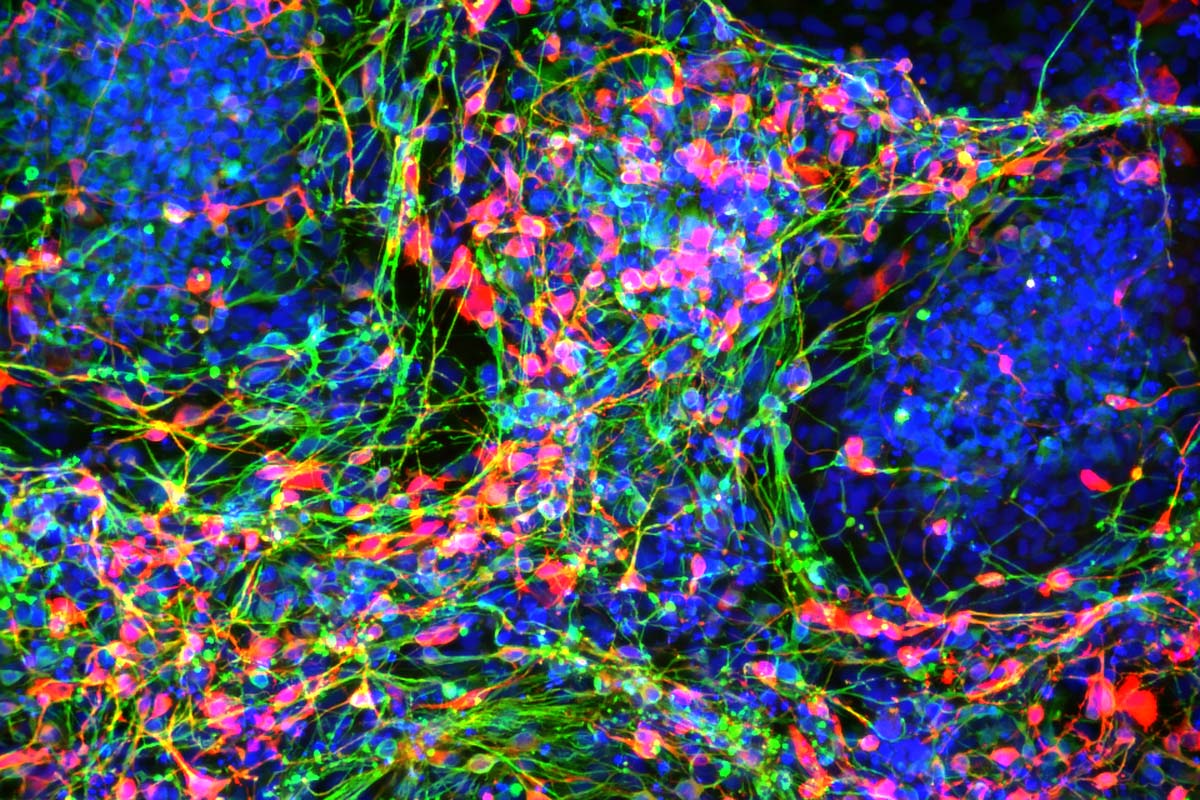
2007年に山中教授が初めて作って報告したヒトiPS細胞は、皮膚の細胞から作られました。その後、さまざまなグループの研究で皮膚以外の細胞、例えば血液細胞からも5~10ccの採血をするだけでiPS細胞を作れるということがわかってきました。ところが、iPS細胞にはもとの細胞の性質を反映しやすい特徴があり、特に血液細胞から作ったiPS細胞は神経細胞に分化しづらく、従来の分化方法では血液細胞から作ったiPS細胞をパーキンソン病の研究に使うことは難しいとわかってきました。そこで私たちは血液細胞から作ったiPS細胞を効率よく神経系細胞へと分化する方法を開発し2016年に発表しました。その結果、パーキンソン病の研究に血液細胞から作ったiPS細胞を使うことができるようになりました(左下画像:iPS細胞から誘導したドーパミン神経細胞(赤色)、神経細胞(緑色)、細胞の核(青色))。
研究に血液細胞から作ったiPS細胞を使うことができるようになると、皮膚を切って皮膚細胞を採取する必要が無く、研究に協力してくださる患者さんの負担が大きく下がります。普段の診療の際に患者さんに説明をして、通常の採血に5~10ccの量の採血を余分にさせていただくことによってiPS細胞を作ることができます。このため、ご協力くださる患者さんが一気に増えました。血液を提供いただくことによって、パーキンソン病の根本的治療法の開発につながるということを多くのパーキンソン病患者さんが理解してくださり、快くご協力をいただけることは大変有難いことだと感じると同時に、研究を必ず進歩させなければいけないと研究者たちは気が引き締まります。

世界的にも珍しい パーキンソン病iPS細胞バンクを設立
このような患者さんたちのご協力を得て、2016年に順天堂大学はパーキンソン病iPS細胞バンク(以下、バンク)を立ち上げ、2021年度までに、約500名の患者さんの細胞を採取させていただきました。そこから順次iPS細胞を作製し、現在では150種類以上のiPS細胞の解析を進めています。
このようなパーキンソン病に特化したバンクは国内では唯一で、世界でもこれほどの数を揃えている細胞バンクはありません。順天堂を受診されるパーキンソン病患者さんの数は国内の医療機関では最も多く、最終的には数千例規模のバンクを樹立し、研究をさらに加速していく計画です(右上画像:パーキンソン病iPS細胞が保存されているタンクと赤松教授)。
スピーディかつ大量に自動解析できる治療薬探索システムの開発に成功
パーキンソン病のうち、家族の中で複数名が発症する家族性パーキンソン病が全体の約10%を占めており、その原因となる遺伝子は約20種類が判明しています。残りの約90%を占める孤発性パーキンソン病では、その原因は不明とされています。
家族性パーキンソン病の一つで、「PARK2」と呼ばれるタイプは 1998年に順天堂大学で発見されました。その原因遺伝子は「パーキン」と名付けられ、これまで順天堂や他の研究機関の研究によって、「パーキン」が上手く働かないPARK2患者さんのドーパミン神経細胞の中では、古くなって不要になったミトコンドリアを上手く取り除けないことが病気の発症と関係していると考えられてきました。2012年に我々はPARK2患者さんのiPS細胞からドーパミン神経細胞を作り、実際にこの現象が起きていることを確認しました。もしもこの損傷ミトコンドリアの除去機能を既存の薬で回復させることができれば、パーキンソン病の発症の予防や進行の抑制につながるのではないかと思われます。しかしながら、その時点でのiPS細胞の解析技術では研究者が長期間かけて作ったドーパミン神経細胞ひとつひとつを顕微鏡で見て解析を行う必要があり、かなりの時間がかかる作業でした。ならば、もっと速く、大量に細胞を解析できる方法はないだろうか――そう考えた私たちは新たな治療薬探索システムを検討し始めました。


自動化システムにより新たな薬の候補を発見
家族性パーキンソン病と孤発性パーキンソン病の両方に効く薬の可能性も示唆
私たちは、まず新しい治療薬を探す過程で必要なiPS細胞からのドーパミン細胞の分化誘導を、従来のものよりかなり小さなスケールで培養することに取り組みました。細胞に何百種類・何千種類という既存の薬を作用させて効果を見ることになるので、培養のスケールが小さい方が同時に多くの薬を検討することができ、実験の効率がよいからです。さらに、細胞のさまざまな現象を高速に読み取り自動的に定量解析するイメージングサイトメーターという機械を活用しました。細胞が死んでしまうときに出すたんぱく質や、ミトコンドリアが取り除かれているかどうかを数値化できるプログラムを独自に作ることで、従来よりもはるかに客観的に沢山の細胞の変化をキャッチできるようになりました。
この自動化システムを使って320種類の薬を検証し、そのうち4種類の薬がミトコンドリアの除去機能に異常があるタイプの家族性パーキンソン病 の症状を改善させる可能性があることがわかりました。さらにバンク内の孤発性パーキンソン病患者さん4人分の細胞を解析したところ、ミトコンドリアの除去機能に異常がある細胞が2名分あり、その2つの細胞に4種類の薬を使ったところ、1つの細胞で症状の改善効果があることがわかりました。この結果から、家族性パーキンソン病の細胞を用いて改善効果のある薬を見つけることが、一部の孤発性パーキンソン病にも有効な薬の開発につながる可能性があるとわかったのです。
バンクの細胞を用いた今後の研究の展開

意外に思われるかもしれませんが、原因遺伝子が明らかな家族性パーキンソン病と、原因不明の孤発性パーキンソン病がどれぐらい共通しているのかは、これまでほとんどわかっていませんでした。というのも、冒頭でお話したとおり現在のパーキンソン病の治療薬は全ての患者さんで同じようにドーパミンを補充する対症療法が行われており、ドーパミン細胞の変化に作用する根本的な治療薬はいまだに登場していません。私たちは、今は共通の治療が行われている孤発性パーキンソン病をiPS細胞を使ってタイプ別に分類することができれば、それぞれのタイプに効果的な治療ができるのではないかと考えています。現在、臨床の現場でパーキンソン病を診療している多くの医師も、症状や進行具合や発症年齢などにより、パーキンソン病にバリエーションがあることに経験的には気づいていますが、現在はそれを客観的に分類する手段がありません。私たちはバンクの細胞の解析結果と実際の患者さんのデータを使って、客観的にそれぞれの症例を評価し、評価したデータに基づいて孤発性パーキンソン病を新たに分類することを試みています。順天堂のバンクには先に述べたようにこれまでにご協力いただいたパーキンソン病患者さんの細胞が数多く保管され、病態メカニズムの解明や新たな治療薬開発に役立てられています。私たちの研究によって、新たな治療法が開発され、パーキンソン病患者さんの日常生活上での困難が少しでも無くなるように、今後も研究に邁進していきたいと考えています。
研究者Profile

赤松 和土
Wado Akamatsu
大学院医学研究科ゲノム・再生医療学
教授
Researchmap